Utérus
Publié le 10 fév 2010Lecture 16 min
Embolisation des myomes. Des indications aux limites.
V. KAHN*, J.-P. PELAGE**, A. FAUCONNIER**, D. MAHIEU-CAPUTO*, P. MADELENAT* - * CHU Bichat - Claude Bernard, Paris - ** CHI Poissy-St Germain, Poissy
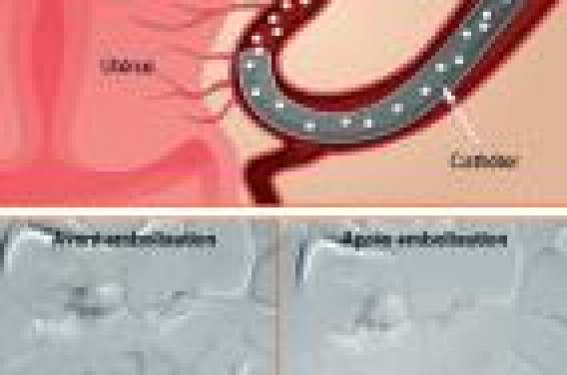
L’embolisation utérine, grâce aux larges améliorations des techniques, est désormais une embolisation sélective des fibromes. En respectant les contre-indications et étant donné son efficacité et sa faible morbidité, ce traitement doit être proposé aux patientes dans l’arsenal thérapeutique de cette pathologie. Il pourrait constituer une thérapeutique efficace et sûre dans une population ciblée de patientes sélectionnées sur des critères stricts et dont le traitement chirurgical, notamment les myomectomies multiples par laparotomie, n’est pas considéré comme satisfaisant, surtout chez les femmes en âge de procréer.
L’embolisation utérine, technique de radiologie interventionnelle est utilisée depuis 1995 dans le traitement des fibromes utérins symptomatiques, à la place de la chirurgie, surtout chez les femmes de plus de 40 ans ne désirant plus de grossesse, en raison des incertitudes sur le devenir de la fonction de reproduction après embolisation. Les résultats de larges études prospectives et des premières études comparatives avec la chirurgie (3-9) sont très encourageants avec des taux d’efficacité de 85-95 % (amélioration des ménorragies, des douleurs pelviennes, des symptômes de compression pelvienne) et des complications graves de l’ordre de 5 %. La courte période de convalescence, la meilleure qualité de vie et l’acceptation du traitement sont aussi des facteurs à prendre en compte. Des améliorations récentes et fondamentales sur l’utilisation de nouvelles particules sphériques calibrées et une technique moins agressive permettent une dévascularisation ciblée des myomes tout en protégeant le myomètre sain, et les branches à destinée cervicale ou vaginale de l’embolisation (10,11). L’embolisation des fibromes utérins (EFU) est un traitement efficace et peu invasif ; néanmoins, la question de l’indication de l’embolisation comme alternative à la myomectomie se pose encore, surtout chez les femmes en âge de procréer. Évolution de la technique d’embolisation des fibromes utérins Dans les premières séries, l’occlusion complète des deux artères utérines par les particules non résorbables de polyvinyl alcoolique non sphériques et mal calibrées (PVA), souvent complétées par des fragments de gélatine ou des coils, était la technique standard utilisée (3,4,6,12-14). Les particules de PVA de forme irrégulière avaient tendance soit à s’agréger, soit à former des fragments de plus petite taille que la taille théorique. L’occlusion artérielle obtenue pouvait ainsi être tout à la fois plus proximale qu’attendu ou plus distale par de petits fragments (15-17). Aujourd’hui, grâce à des études précliniques et cliniques (11,17), la technique standard d’embolisation consiste à réaliser une dévascularisation ciblée des fibromes en préservant le myomètre, l’endomètre, les ovaires et la région cervico-vaginale grâce à l’utilisation de microsphères calibrées d’une taille > 500 μm Embosphères (les branches artérielles du réseau périmyomateux venant de l’artère utérine mesurant entre 500 et 900 μm). De plus, l’embolisation est réalisée de façon moins agressive, c’est-à-dire plus limitée qu’auparavant : la seule cible est le plexus artériel périmyomateux laissant perméable l’artère utérine principale de façon à préserver les branches du myomètre normal et les branches à destinée cervicale ou vaginale (10,11). Figures 1, 2 et 3. Technique de dévascularisation ciblée. Les études IRM avec produit de contraste ont permis de montrer que le myomètre et l’endomètre sains sont normalement perfusés après embolisation (18,29,30) et que seules les zones myomateuses dévascularisées apparaissent en hypersignal T1 et ne se réhaussent pas après injection de gadolinium (figures 1 à 3) (18, 23, 30). Complications postembolisation Les complications de l’embolisation sont évaluées, selon les études, à environ 5 %. Complications mineures Douleurs, fièvre, nausées postembolisation étaient les plus fréquemment observées, mais la diminution de l’agressivité de l’embolisation et la prise en charge par des protocoles d’anesthésiologie ont permis une nette amélioration de ces symptômes. Complications majeures Leur taux a été évalué à 1,25 % dans une étude portant sur 400 patientes, dont une hystérectomie (0,25 %) (28). Toutefois, la plupart des complications rapportées dans la littérature sont survenues avec les anciennes techniques d’embolisation utilisant les particules de polyvinyl alcoolique de trop petite taille et/ ou avec occlusion complète des deux artères utérines entraînant une ischémie utérine sévère (4,31). L’infection est une des complications graves, mais rares (< 1 %), qui serait favorisée par la localisation sous-séreuse et le type pédiculé des fibromes, ainsi que par la grande taille des fibromes (3-7,13,32). Dans deux cas, un sepsis pelvien grave non diagnostiqué a conduit au décès de la patiente (33,34). La possibilité d’aménorrhée transitoire ou définitive Associée ou non à d’autres symptômes de ménopause (bouffées de chaleurs et élévation de la FSH), elle a été rapportée après embolisation. Le taux d’aménorrhée définitive varie de 2 à 5 % sur les grandes séries publiées (5-7,35), mais dépend principalement de l’âge de la patiente puisque la plupart des cas sont rapportés chez des femmes de 45 ans ou plus, alors qu’elle est exceptionnelle en dessous de 40 ans (36,37). L’existence d’une FSH élevée en préopératoire serait fortement prédictive d’une insuffisance ovarienne définitive après embolisation utérine (38). Les mécanismes évoqués seraient aussi la vascularisation ovarienne assurée de façon prédominante par l’artère utérine ou une anastomose utéro-ovarienne très large. L’utilisation de microsphères de grande taille (> 500 μm), l’embolisation ciblée et la protection de l’ovaire par une spirale métallique si l’anastomose est de grand diamètre, devrait permettre de prévenir cette complication (39). Plusieurs facteurs identifiés comme causes d’échec ou de récidive clinique après embolisation (40) L’embolisation d’une seule artère utérine, la vascularisation des fibromes par les artères ovariennes, le spasme lors de l’embolisation peuvent conduire à un échec ou une récidive précoce (4,6,40-42). Ainsi, la plupart des récidives cliniques dans les 2 ans sont liées à une dévascularisation incomplète, comme cela a été démontré par le suivi de la perfusion des fibromes en IRM (29,30). Les premières études à moyen terme suggèrent des taux de récidives de 5 à 10 %. L’adénomyose associée constitue également une cause de récidive clinique (43,44). L’absence d’amélioration clinique et l’augmentation de taille d’un fibrome embolisé, surtout s’il est unique, doivent faire suspecter un sarcome, même si c’est exceptionnel (45). Efficacité de l’EFU et comparaison avec la chirurgie L’efficacité de l’EFU a été évaluée par l’amélioration des symptômes comme les ménorragies, les douleurs pelviennes ou les symptômes de compression d’organes. Les taux d’efficacité de l’embolisation dans la littérature sont de 84 à 100 %, la plupart des séries rétrospectives et prospectives retrouvant une réponse efficace dans 95 % des cas (3-7,11-13). Le taux de satisfaction des patientes a été évalué par des questionnaires de qualité de vie corrélés à l’amélioration des symptômes (13,28). Walker et Pelage ont ainsi rapporté que 97 % des patientes étaient satisfaites de la technique et la recommandaient (6). La diminution du volume utérin et du volume des fibromes a été évaluée par échographie et IRM pelvienne dans les 3 à 6 mois suivant l’embolisation. La réduction de volume utérin a été rapportée entre 25 et 60 % et celle du volume du fibrome dominant, évaluée entre 33 et 68 % (3-7,11-13). Dans trois études rétrospectives comparant embolisation et myomectomies multiples par laparotomie, il a été démontré que l’embolisation est plus efficace que la chirurgie pour traiter les ménorragies, que les complications sont moins importantes, tandis que la durée d’hospitalisation et les délais de reprise des activités sont plus courts(8,24,25). Une étude multicentrique prospective, comparant embolisation et myomectomie, confirme les résultats précédents (9). Les résultats préliminaires d’une autre étude prospective comparant myomectomie et embolisation montrent une efficacité comparable des deux stratégies thérapeutiques sans complications majeures, avec moins d’anémie dans le groupe embolisation, une plus courte convalescence, mais davantage de réinterventions (26). Dans une étude randomisée récente, comparant embolisation et hystérectomie par laparotomie, l’embolisation était associée à des taux de complications postopératoires inférieurs, à une durée de convalescence et d’hospitalisation plus courte, alors que la qualité de vie était équivalente entre les deux groupes (27). Dans l’étude multicentrique rétrospective HOPEFUL, comparant hystérectomies à embolisation chez 1 108 femmes, les deux techniques s’avèrent être sécurisées avec moins de complications sévères dans le groupe embolisation, mais avec 23 % de recours à un autre traitement pour les fibromes (54). Dans la plus grande étude prospective multicentrique portant sur 3 160 patientes, les conséquences à court terme étaient minimes (0,66 % de complications majeures, 0,1 % d’hystérectomies) (55). La récente revue Cochrane, reprenant deux essais randomisés, comparant l’embolisation à l’hystérectomie, et un essai randomisé comparant l’embolisation à la myomectomie, confirme l’embolisation des fibromes comme une option thérapeutique avantageuse dans la prise en charge des fibromes (56). Indications de l’EFU Aujourd’hui, étant donné les taux d’efficacité et la faible morbidité de cette technique, l’embolisation utérine devrait être proposée dans l’arsenal thérapeutique des fibromes chez les femmes ne désirant plus de grossesse au même titre que le traitement chirurgical (hystérectomie ou myomectomie), après discussion avec la patiente et en fonction de multiples facteurs. L’utilisation des particules calibrées, la dévascularisation ciblée des myomes, ainsi que le respect des contre-indications, donnent toute sa place à ce traitement en alternative au traitement chirurgical. En effet, le principal facteur de réussite et d’efficacité de l’EFU est la sélection appropriée des patientes qui doit être faite lors de staffs pluridisciplinaires réunissant gynécologues et radiologues. Outre l’examen clinique, une évaluation précise des symptômes et de leur impact sur la qualité de vie doit être réalisée. L’âge de la patiente et son éventuel désir de grossesse ultérieure sont des éléments essentiels à discuter. Une évaluation précise de la taille et de la localisation des fibromes utérins doit être effectuée par l’imagerie, notamment l’IRM et l’échographie Doppler pelvienne, ce qui permettra d’orienter le traitement. Ainsi, les fibromes à composante uniquement sous-muqueuse doivent être traités par hystéroscopie opératoire s’ils sont accessibles, évitant une expulsion des myomes nécrosés. Les fibromes sous-séreux pédiculés ne doivent pas être traités par embolisation (3,4,13,22), le pédicule pouvant se nécroser et entraîner une irritation péritonéale, une infection et des adhésions digestives (4). La viabilité du myome doit être évaluée par l’étude de sa vascularisation, qui constituerait un facteur de réussite de l’embolisation, en échographie-Doppler ou IRM avec injection de chélate de gadolinium, les myomes nécrosés et calcifiés ne répondant pas à l’embolisation (19,20,23). Par ailleurs, on doit s’assurer de l’absence de pathologie tubaire (hydrosalpinx) ou ovarienne. Place de l’EFU chez les femmes jeunes Les complications décrites dans la littérature ont amené à proposer l’embolisation utérine surtout chez les femmes de plus de 40 ans ne désirant plus de grossesse en raison des incertitudes sur le devenir de la fonction de reproduction après embolisation. Or, ces complications ont été décrites chez des femmes de plus de 45 ans ayant une réserve ovarienne préalablement altérée et surtout avec les anciennes techniques d’embolisation. Depuis, plusieurs études ont montré une absence d’altération du bilan hormonal reflétant la réserve ovarienne chez les femmes de moins de 40 ans avec un statut préembolisation normal. Les techniques actuelles d’embolisation ciblée du plexus artériel périmyomateux pourraient donc permettre d’élargir les indications d’embolisation. L’embolisation utérine pourrait ainsi se justifier chez les femmes jeunes désirant conserver leur potentiel de procréation et présentant de nombreux fibromes interstitiels symptomatiques ou impliqués dans une infertilité prouvée inexpliquée, chez qui une myomectomie multiple serait nécessaire, mais néanmoins jugée délétère. Les études publiées sur les myomectomies par laparotomie et les études comparatives avec l’embolisation vont dans le même sens. En effet, les polymyomectomies par laparotomie sont responsables, dans 90 % des cas, de la formation d’adhérences pelviennes (46,47), notamment tubo-ovariennes (65 %), entraînant des infertilités secondaires mécaniques définitives, des saignements peropératoires importants pouvant nécessiter une transfusion sanguine dans 20 % des cas (48) ; la cavité utérine est fragilisée, avec un risque de rupture utérine en cas de grossesse ultérieure ; la récidive myomateuse survient dans 30 % des cas dans les 2 à 5 ans (49). Le taux de conception après embolisation utérine est actuellement mal connu, en raison du très faible nombre d’études publiées et dont l’évaluation de la fertilité n’était pas le critère principal. Toutefois, plus de 250 grossesses ont été publiées après embolisation avec des taux de conception entre 33 à 100 % selon les études, ce qui est comparable au taux de grossesses post-myomectomie. La récente étude randomisée de Mara de 2007 comparant l’EFU versus la myomectomie (fibrome > 4 cm) chez 121 femmes, confirme l’absence de différence en termes d’efficacité, de succès technique, de stabilité du bilan hormonal, de récidives et réinterventions, et de complications (57). Les patientes embolisées présentaient des durées d’intervention, d’hospitalisation, de convalescence plus courtes qu’avec la chirurgie. Les grossesses décrites après EFU ont présenté un taux plus important de fausses couches, prématurité, et césariennes que dans la population générale, mais l’âge était aussi plus élevé et les myomectomies connaissent aussi des complications similaires, notamment la rupture utérine qui n’a pas été décrite après EFU. D’autres études randomisées sont nécessaires avec les nouvelles techniques d’embolisation et la sélection appropriée des patientes. Étant donné les récentes améliorations techniques et la morbidité liée à la chirurgie extensive des myomes, ainsi que le pronostic incertain en termes de fertilité et de conséquences obstétricales, l’embolisation sélective des myomes ne peut se concevoir actuellement chez les femmes jeunes, que dans le cadre d’un protocole de recherche ou de façon compassionnelle. Protocole LUNE (Léïmyomatomes UtériNs Embolisés) Ainsi, nous avons élaboré le protocole de recherche LUNE, dont le promoteur est l’AP-HP, visant à évaluer la fertilité spontanée après embolisation sélective des myomes utérins chez les femmes présentant une polymyomatose utérine diffuse symptomatique avec un désir de grossesse immédiat. À l’aide d’autoquestionnaires, d’examens cliniques, de bilan hormonaux (FSH, LH, estradiol, AMH, inhibine B, compte des follicules antraux), d’imagerie (échographie-Doppler utérin et IRM pelvienne) et par une hystéroscopie et coelioscopie d’inventaire post-embolisation (adhérences, synéchies, biopsie endométriale), nous pourrons évaluer, avant et après embolisation, l’évolution des symptômes dus aux fibromes, la tolérance et les effets secondaires de l’embolisation sur la fonction de reproduction, le nombre de grossesses post-embolisation. L’étude récemment mise en place est prospective, ouverte, interventionnelle, et les deux centres investigateurs sont les services de gynécologie obstétrique des hôpitaux Bichat et Poissy (Tableau). Une étude préliminaire compassionnelle a été pratiquée dans ces deux mêmes centres devant le recrutement d’une population jeune demandeuse d’un traitement alternatif à une hystérectomie qui leur avait été proposée (notamment récidives après myomectomies multiples). Vingt-huit patientes ont été sélectionnées entre Bichat et Poissy, d’âge moyen de 36,3 ± 3,9 ans (27,6- 40,9 ; médiane : 36,2), d’origine afro-caribéenne dans 64,3 % des cas. Vingt patientes ont déjà bénéficié de l’embolisation sélective selon le protocole recommandé chez les femmes jeunes avec des microparticules calibrées de plus de 500 μm jusqu’à 1 200 μm (Embosphères) ; elle était bilatérale dans 100 % des cas. L’évaluation préembolisation en IRM retrouvait, dans 93 % des cas, plus de 5 myomes et la comparaison à 3 mois de l’EFU a permis d’évaluer 56 fibromes chez 18 femmes : 95 % des fibromes ont bénéficié d’une dévascularisation complète ; 15 patientes (83 %) ont eu une dévascularisation complète de tous leurs fibromes. On note une réduction de volume de l’utérus de 37 %, des trois plus gros fibromes de 35, 31 et 32 %. Les patientes ont été améliorées au point de vue des ménorragies, des douleurs et de la compression dans respectivement 94, 83 et 94 % des cas. La durée des règles était significativement diminuée de 7 ± 4,6 jours à 4,8 ± 3 j après embolisation ; 83 % des patientes étaient satisfaites, et le score de qualité de vie amélioré dans tous les cas. Les bilans hormonaux comprenant notamment la FSH, l’AMH et l’inhibine B sont restés stables. Il n’y a eu aucune complication postembolisation, aucune aménorrhée et aucune infection, des leucorrhées transitoires dans 3 cas. Dans cette étude préliminaire, les résultats ont donc montré l’efficacité de l’EFU sur les symptômes, la qualité de vie, la réduction du volume utérin et des myomes et leur dévascularisation, l’innocuité du traitement par la stabilité des bilans hormonaux et l’absence de complications. Le protocole LUNE se justifie donc d’autant plus. POINTS À RETENIR • Le protocole LUNE en cours pourrait répondre à certaines des questions encore non élucidées, mais un essai randomisé sera indispensable afin de comparer la chirurgie extensive à l’embolisation en termes de fertilité et de suivi des grossesses. • Dans tous les cas, la patiente doit être prise en charge par une équipe pluridisciplinaire associant radiologues interventionnels et chirurgiens gynécologues afin de choisir la meilleure stratégie possible, d’informer soigneusement la patiente sur les risques de la technique, et gérer le suivi et les complications éventuelles.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :



