Publié le 28 jan 2013Lecture 11 min
Traitement des fibromes utérins par ultrasons
H. TRILLAUD, Service d’Imagerie diagnostique et interventionnelle, Groupe hospitalier Saint-André, Bordeaux
L’ablathermie est un mode de traitement largement répandu en utilisant différents agents physiques, dont les ultrasons (US). Seuls les US sont capables de traverser les tissus sans les léser et sans nécessiter de les pénétrer à l’aide d’un applicateur, tout en se focalisant sur une cible à détruire. L’IRM permet de réaliser une imagerie de température. Le couplage récent des US focalisés à l’IRM permet donc un monitorage en continu de la température tissulaire et le suivi de l’effet d’échauffement des tissus par les ultrasons. L’application la plus répandue actuellement est constituée par le traitement du fibrome utérin.
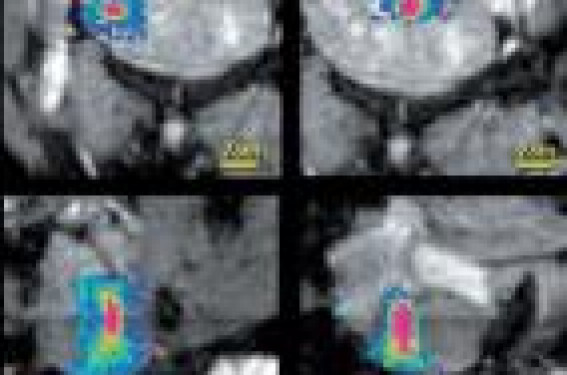
Aspects techniques Les US focalisés Les ultrasons constituent une énergie mécanique qui se propage sous la forme d’une onde vibratoire transmise aux particules de tissu. La focalisation du faisceau US est possible à partir de transducteurs à surface concave, permettant de faire converger le faisceau ultrasonore en un point appelé « zone focale » situé à une distance variable du transducteur, appelée « distance focale ». Des transducteurs multiéléments en réseau phasé (phased-array) sont utilisés. Il est possible de faire varier la distance focale ainsi que l’axe de tir grâce à l’angulation électronique. Le balayage de la zone cible par le point focal peut donc être assuré, soit par un déplacement mécanique du transducteur, soit par une angulation électronique, soit les deux. Une focalisation satisfaisante des ondes US à travers la peau nécessite une large fenêtre acoustique (de la taille du transducteur), sans interface aérique ou osseuse, ce qui nécessite l’interposition d’un matériel de couplage (comme en échographie). Cet effet de focalisation est maximal lorsque la phase de toutes les ondes émises par le transducteur est identique en atteignant la zone focale. Ceci est d’autant plus efficace que les milieux traversés sont homogènes. Les tissus hétérogènes vont être à l’origine de multiples réflexions acoustiques et ainsi générer des hétérogénéités de phase et d’atténuation entre le transducteur et la cible, altérant la qualité de la focalisation. Ce phénomène de défocalisation présente le double risque d’être inefficace au niveau de la cible et de voir apparaître des foyers secondaires à distance qui pourraient léser les tissus sains. La forme du point focal ressemble à celle d’un cigare, ellipsoïde allongée, dans l’axe du faisceau ultrasonore. La longueur de la zone focale (plusieurs mm) est plus importante que son diamètre (de l’ordre du mm) (figure 1). Le traitement du fibrome nécessite de déplacer le foyer pour couvrir tout le volume à traiter, en incluant une marge de sécurité. Figure 1. Aspect en imagerie IRM de température de cellules de 4 mm, 8 mm, 12 mm et 16 mm de droite à gauche et en coupe coronale en haut et sagittale en bas. Noter l’aspect du volume d’insonification qui ressemble à celui d’un cigare, ellipsoïde allongée, dans l’axe du faisceau ultrasonore. La longueur de la zone focale est plus importante que son diamètre. Effet des US sur le fibrome Les US focalisés créent un effet d’hyperthermie dans les tissus, qui dépend de l’intensité du faisceau, du coefficient d’absorption du tissu, en fonction de sa composition, et de la longueur d’onde du faisceau. Le niveau d’hyperthermie atteint dépendra de la puissance acoustique délivrée, du mode de délivrance des insonifications, des caractéristiques des tissus traversés et des sources de refroidissement. Pour le fibrome, la perfusion est un élément important qui augmente la dispersion de la chaleur et donc le refroidissement.Les fibromes très perfusés nécessiteront d’augmenter l’énergie des US utilisés. De même, il a été montré que les fibromes dont le signal T2 est élevé sont plus difficiles à détruire. En pratique, ce signal en T2 est comparé au muscle strié ou au myomètre. S’il est supérieur, le fibrome est plus difficile à traiter. Ces derniers éléments sont souvent difficiles à prédire, ce d’autant qu’ils vont varier avec le développement de la nécrose de coagulation. Le monitorage de la température d’échauffement, et donc de la « dose thermique » délivrée au tissu, est un avantage important de cette approche pour adapter en temps réel la puissance délivrée. La température efficace (à atteindre) pour détruire le tissu est de 60 °C. Sur notre système, la température de sécurité est de 70 °C avec une coupure automatique au-delà. Monitorage de la température Avec les autres thermothérapies comme la radiofréqence (RF), l’applicateur constitué par une aiguille est bien visible dans le tissu. En revanche, le foyer d’application de l’énergie délivrée par les ultrasons n’est pas visible spontanément et le monitorage de la température est donc fondamental. Sa position théorique peut être estimée en tenant compte des caractéristiques et de la position du transducteur par rapport à la cible. Il ne peut être visualisé que par l’intermédiaire de l’élévation de température qu’il produit. En IRM, il est possible de mesurer dans les tissus des variations de température par rapport à une température corporelle de base. En effet, les modifications de température entraînent des modifications de la phase du signal qui peuvent être quantifiées. En pratique, on réalise des séquences d’écho de gradient dont la résolution est de moins d’une seconde. Ainsi, on peut établir des cartographies bi- ou tridimensionnelles de la température, régulièrement renouvelées au cours du chauffage, avec une résolution temporelle de moins d’une seconde et une précision de moins d’un degré (figure 2). Figure 2. Image de température en fin d’insonification. Noter l’échelle de température sur la gauche de l’image. Cette image est rafraichie toutes les 0,8 secondes pendant l’insonification. En prenant en compte la température et le facteur temps, il est possible d’obtenir en parallèle des cartes de dose thermique (puisque la dose thermique est le produit de la température par le temps). La dose thermique a l’avantage de fournir une information d’accumulation de chaleur avec le temps qui est le facteur déterminant pour la caractérisation du niveau de lésion induite. Le monitorage par IRM permet, par ailleurs, de fournir une cartographie morphologique 3D idéale du fibrome à traiter et de pouvoir positionner chaque tir avec précision.Il nécessite, bien entendu, de pouvoir disposer de plateformes de traitement ultrasonore intégrées dans le lit de l’aimant, avec un transducteur mobilisable par déplacement mécanique dans 2 ou 3 directions, et qui sont disponibles depuis déjà quelques années (figure 3). En fin de traitement, la réalisation d’une séquence après injection de produit de contraste permet d’évaluer le volume de tissu non rehaussé par le produit de contraste et donc a priori détruit. Automatisation du système : asservissement automatique des HIFU* à l’imagerie de température Actuellement, la plateforme que nous utilisons (Philips Healthcare) permet, grâce au monitorage de la température, de pouvoir piloter automatiquement la puissance du transducteur ultrasonore, et ainsi l’énergie qu’il délivre à la cible, en fonction d’un protocole et d’un niveau de dose thermique prédéfinis. Autrement dit, c’est l’IRM qui contrôle la puissance délivrée par le transducteur et donc la dose thermique (figure 4). *HIFU : High Intensity Focused Ultrasound. Figure 4. Boucle de rétrocontrôle entre la table d’IRM incluant le transducteur d’ultrasons focalisés, le monitorage de la température et le transducteur ultrasonore. L’énergie délivrée au fibrome est automatiquement contrôlée par l’imagerie de température et la dose thermique. Un autre système est disponible en clinique et a été développé par la société InSightec et fonctionne avec les IRM General Electric. Les constructeurs Philips et General Electric offrent donc en option la possibilité de l’achat d’un système d’ultrasons focalisés qui comprend un lit dans lequel sont inclus le transducteur d’ultrasons focalisés, un générateur d’ultrasons de haute énergie, toute l’interface électronique et informatique avec la machine IRM et les séquences d’analyse de la température. Réalisation pratique d’un traitement Le traitement est réalisé en ambulatoire avec seulement un traitement sédatif léger pendant le geste. Une sonde urinaire est mise en place afin d’éviter un remplissage de la vessie pendant l’acte interventionnel et une modification de la position du fibrome. La patiente a épilé la région en regard du fibrome ; elle est positionnée à plat ventre avec le fibrome en regard du transducteur d’US focalisé intégré à la table d’IRM. Un couplage soigneux par un gel hydrique est réalisé afin d’éviter la présence de bulles d’air à la surface cutanée. Des coupes de repérage du fibrome sont réalisées et permettent de vérifier également l’absence de bulles d’air à la surface du fibrome et à la fenêtre acoustique sans interposition aérique ou osseuse. Le volume du fibrome à détruire est déterminé en fonction de sa taille et de la fenêtre acoustique. Le traitement est réalisé par insonifications successives en déplaçant le point focal dans le fibrome (figure 5). Figure 5. Exemple de planification du traitement après acquisition d’image IRM anatomique en T2 et après injection de produit de contraste. Le volume à traiter (cercle rose), le cône d’ultrasons focalisés et le transducteur sont visualisés ainsi que le volume des insonifications programmées (en vert). Cette représentation permet de visualiser le faisceau d’ultrasons et de modifier éventuellement l’orientation du transducteur et, par là-même, le faisceau d’ultrasons et le volume à traiter. Figure 6. Exemple du traitement d’un fibrome par ultrasons focalisés avec l’aspect en (A) sur une image en T2 et avec injection (B) avant traitement. L’image (C) montre un volume non perfusé quantifié à 80 % juste après traitement. À 1 mois (D), puis à 6 mois (E), le fibrome a diminué de taille. Il est possible de choisir des volumes de traitement différents pour chaque insonification avec des diamètres de 4 à 16 mm pour des volumes de destruction de 0,1 à 6 cm3 (figure 1). L’objectif de l’insonification est d’atteindre une température cible de 60 °C dans le volume choisi et chaque insonification dure en pratique entre 20 et 70 secondes. Nous avons défini arbitrairement une durée maximale de traitement supportable de 2 heures, car la patiente doit rester immobile et à plat ventre durant le traitement. Ce traitement est plus court si l’ensemble du volume défini est détruit avant les 2 heures. À la fin du traitement, une séquence après injection de produit de contraste est réalisée et permet de mesurer le volume de fibrome non perfusé (figure 6 A à E). La patiente est ensuite sortie de la machine et surveillée 2 heures avant sa sortie. Un traitement anti-inflammatoire et antalgique per os est alors prescrit. L’activité normale peut être reprise rapidement, dès le lendemain, voire le surlendemain selon les douleurs ressenties. Qu’attendre du traitement ? La diminution de taille du fibrome après 6 mois-1 an est comprise en moyenne entre 15 et 30 % dans la littérature. L’amélioration clinique est quantifiée dans la pratique à l’aide d’un score largement utilisé et reconnu, basé sur les symptômes liés au fibrome et la qualité de vie (score UFS-QOL). Il existe une diminution de ce score compris entre 15 et 30 points et donc une amélioration clinique. Pour simplifier, parmi les patientes traitées, 20 % nécessiteront un traitement complémentaire à 1 an. Quelles patientes ce traitement concerne-t-il ? Il n’y a pas de contre-indications formelles à ce traitement. Dans notre expérience, nous réservons cette méthode à des patientes dont le fibrome est accessible avec une bonne fenêtre acoustique et une profondeur compatible avec la distance focale maximale (de 10 à 15 cm selon les machines). La présence d’interposition digestive entre le fibrome et la paroi ne permet pas de réaliser ce traitement (figure 7). La présence de calcifications ou de clips dans le faisceau d’ultrasons doit être éliminée. De même, les cicatrices (césarienne, myomectomie, etc.) au contact du transducteur peuvent provoquer un échauffement local à surveiller attentivement. Nous excluons les patientes avec un utérus polymyomateux, des règles très hémorragiques (nous préférons l’embolisation utérine dans ce cas), ou un syndrome de masse très invalidant. Dans ce dernier cas, il est possible de réaliser le traitement par ultrasons focalisés après traitement par analogues de l’hormone de libération de la lutéinostimuline (LHRH) qui va faire diminuer la taille du fibrome. Figure 7. Chez cette patiente le traitement n’est pas réalisable. Le volume à traiter (cercle rose) et le cône d’ultrasons focalisés et le transducteur sont visualisés, mais il existe des structures digestives dans le faisceau d’ultrasons focalisés.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :


