Cancérologie
Publié le 09 nov 2008Lecture 15 min
Traiter les CIN de haut grade
J.-J. BALDAUF, E. BAULON, C. YOUSSEF, V. THOMA Hôpital de Hautepierre-Hôpitaux Universitaires de Strasbourg
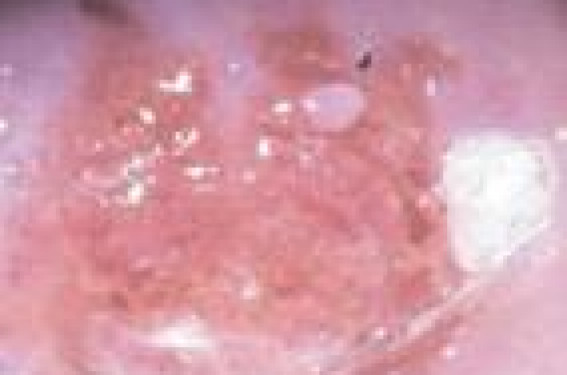
Les néoplasies intraépithéliales (CIN) de haut grade se développent à partir de la jonction cylindro-malpighienne et de la zone de transformation anormale, et précèdent les carcinomes épidermoïdes, qui représentent environ 80 à 90 % des lésions invasives du col de l’utérus. Il s’agit d’un éventail de lésions caractérisées par une désorganisation architecturale et une prolifération de cellules atypiques plus ou moins différenciées de la couche basale occupant plus du tiers de l’épaisseur de la muqueuse. L’histoire naturelle de ces lésions prénéoplasiques fait du cancer du col une pathologie particulièrement accessible au dépistage. En effet, le traitement des CIN de haut grade permet dans la grande majorité des cas de prévenir le développement ultérieur d’un cancer invasif.
Fréquence des néoplasies intracervicales (CIN) et risque de développement du cancer du col Les CIN sont des lésions asymptomatiques. Leur incidence et leur prévalence sont difficiles à préciser du fait de la reproductibilité imparfaite des critères de définition et des variations interobservateurs caractérisant les modalités de leur diagnostic (1). Les données épidémiologiques récentes suggèrent une augmentation de l’incidence et de la prévalence des CIN et une diminution de la moyenne d’âge des patientes porteuses de ces lésions (2,3). Des critères de définition à la fois plus précis et plus constants au cours des dernières décennies, et la meilleure reproductibilité du diagnostic des CIN de haut grade et du cancer facilitent l’appréciation du risque de développement du cancer. À l’inverse, pour des raisons évidentes d’éthique médicale, il n’est absolument pas possible de concevoir une étude prospective de cohorte pour quantifier le risque de cancer chez les femmes présentant un CIN. Dans sa revue de la littérature portant sur 50 études, Östor (4) notait un taux de progression vers le cancer de 5 % pour les CIN II et de plus de 12 % pour les CIN III. En fait, cette revue porte principalement sur des études où le diagnostic des lésions et de leur évolution repose sur le frottis, dont on connaît le manque de fiabilité diagnostique. Il s’agit, par ailleurs, d’études rétrospectives dont la proportion quelquefois importante de patientes ayant temporairement échappé à la surveillance, constitue un biais de recrutement non négligeable. Dans une étude portant sur des CIN authentifiés par un examen histologique, le taux de progression des CIN II et CIN III a été estimé à 39 % avec un risque de développement de cancer pouvant atteindre 25 % (5,6). La durée réelle de la phase préinvasive n’est pas encore déterminée avec précision. Le délai moyen entre un CIN de haut grade et un cancer est estimé à au moins 10 ans. Des évolutions plus rapides sont régulièrement rapportées et constituent une des causes principales des cancers d’intervalle (7). Elles concernent surtout les patientes jeunes et les lésions avec une composante glandulaire (7,8). La persistance de l’infection par le même type d’HPV et la charge virale élevée ont été identifiées comme des facteurs de risque de persistance et de progression des CIN, mais actuellement il n’existe aucun argument en faveur d’une augmentation du taux de progression vers le cancer ou d’un raccourcissement du délai d’apparition du cancer associé à l’infection HPV (7). Les données épidémiologiques récentes suggèrent une augmentation de l’incidence et de la prévalence des CIN et une diminution de la moyenne d’âge des patientes porteuses de ces lésions. Le taux de progression des CIN II et CIN III a été estimé à 39 % avec un risque de développement de cancer pouvant atteindre 25 %. Les objectifs du traitement Le traitement des CIN n’est justifié que pour éviter leur évolution vers un cancer. Ce traitement ne devrait concerner que les lésions prouvées par l’examen histologique d’une biopsie irigée et/ou d’un curetage endocervical. Dans ce cas, la colposcopie associée à la cytologie et à l’examen histologique permet de poser les indications thérapeutiques et de choisir la modalité thérapeutique la plus adaptée. Le choix de la méthode et de l’étendue du traitement doit être fait avec le double souci de l’efficacité et de la moindre iatrogénie. L’efficacité dans la prévention du cancer invasif exige l’ablation ou la destruction la plus complète possible de l’épithélium pathologique. La moindre iatrogénie requiert la conservation d’un maximum d’épithélium et de stroma sains pour préserver la fonction du col pour la fécondation, le maintien de la grossesse et l’accouchement, et pour éviter les troubles fonctionnels. En pratique, une application de lugol permet de repérer les limites externes de la lésion que le traitement destructeur ou l’exérèse doit déborder avec une marge de sécurité d’environ 3 mm. CIN 3 sur col gravide sans préparation. Les méthodes thérapeutiques L’absence de pièce opératoire onstitue un inconvénient majeur our l’ensemble des méthodes destruction. L’impossibilité de réaliser un examen histologique rive le thérapeute de deux renseignements essentiels : celui concernant le caractère complet ou non du traitement et celui sur la sévérité exacte de la lésion, et plus particulièrement sur l’existence d’un foyer microinvasif ou invasif qui aurait pu passer inaperçu au bilan préopératoire. Entre 0,5 et 8 % des cancers sont ainsi découverts à l’examen des pièces d’exérèse. Ces pourcentages varient essentiellement en fonction des modalités du bilan préopératoire, de la sévérité présumée des lésions et de leur extension endocervicale. Généralement, le petit foyer invasif ou micro-invasif existe, mais passe inaperçu aux examens préopératoires (9-11). L’exérèse est recommandée pour traiter ces lésions. Les dimensions de l’exérèse dépendent de la taille et de la situation de la lésion sur le col. Parmi les méthodes de destruction, la vaporisation au laser a l’avantage de la faible propagation de l’énergie qui limite les dégâts thermiques à 0,1 - 0,5 mm et favorise la précision du geste et la qualité de la cicatrisation. Un traitement par destruction ne peut être proposé que pour les lésions de petite taille, de situation exocervicale, totalement visibles à la colposcopie et chez une patiente qui accepte une surveillance postopératoire régulière. Parmi les méthodes d'exérèse, les conisations au laser et les conisations à l’anse diathermique (CAD) ont peu à peu remplacé les conisations au bistouri froid en raison de leur précision, de la qualité de l’hémostase obtenue sans suture cervicale et, en ce qui concerne les conisations à l’anse diathermique, du faible coût, de la simplicité de la technique et de l’apprentissage facile (9,10,12). La réalisation de ce geste se fait, dans la très grande majorité des cas, sous anesthésie locale en consultation externe ou dans une unité de chirurgie ambulatoire. La forme et la taille de l’anse doivent être adaptées à la lésion afin d’obtenir une exérèse complète et une épargne maximale de tissus cervicaux sains. L’utilisation des nouveaux générateurs avec courant de haute fréquence permet de réaliser une section avec des altérations thermiques très réduites. La modulation automatique de l’intensité, du voltage et de la fréquence du courant de section, en fonction de l’impédance du tissu traversé, permet d’obtenir une section de qualité optimale quelle que soit la taille de l’anse utilisée. Une résection endocervicale complémentaire avec une anse de petit diamètre peut s’avérer nécessaire lorsque la hauteur de l’exérèse à réaliser est supérieure au diamètre des anses. Dans ces cas, l’identification et l’orientation précise des différents fragments sont indispensables pour la bonne interprétation anatomopathologique et notamment pour l’appréciation du caractère complet de l’exérèse. Une destruction périphérique par électrocoagulation ou par vaporisation permet d’éviter une exérèse trop importante en cas de lésions exocervicales très étendues. Décider de la profondeur d’exérèse est particulièrement difficile lorsque la limite supérieure de la lésion n’est pas visible à la colposcopie. Certains proposent de faire une recoupe endocervicale dans ces cas. L’analyse histologique de cette recoupe permet plus aisément d’affirmer le caractère complet de l’exérèse (13,14). Pour la majorité des auteurs, le curetage endocervical associé à la conisation n’est pas recommandé en raison de sa faible valeur prédictive positive (15-17). L'hystérectomie peut être proposée en cas de lésions gynécologiques associées ou comme traitement de deuxième intention. En traitement de première intention, il apparaît à la fois excessif et inadapté. Il comporte un risque de sous-traitement en cas de lésions micro-invasives ou invasives méconnues au bilan préopératoire et ne garantit pas l’absence de récidives vaginales (18). Pour le traitement des CIN de haut grade, l’absence de pièce opératoire constitue un inconvénient majeur pour l’ensemble des méthodes de destruction car on estime entre 0,5 et 8 % la fréquence des foyers micro-invasifs ou invasifs qui auraient pu passer inaperçus au bilan préopératoire. CIN 3 sur col gravide avec lugol. Les résultats thérapeutiques La CAD, qui constitue pour les raisons évoquées plus haut la méthode de traitement la plus utilisée actuellement, permet d’obtenir des taux de guérison variant selon les auteurs entre 83 et 96 % avec des durées moyennes de surveillance allant de 3 mois à 22 ans (11-13,17,19,21). Une métaanalyse portant sur 22 études randomisées sélectionnées parmi 1 201 publications a montré un taux de lésions résiduelles variant de 5 à 15 % pour une durée de surveillance post-thérapeutique d’au moins 12 mois (22). Ni la sévérité des lésions traitées ni le type de traitement (cryothérapie, vaporisation laser, CAD et conisation au bistouri) n’ont influé significativement sur le taux de guérisons (22). Une revue de la littérature publiée en 2000 aboutit à une conclusion similaire (23). En cas d’exérèse, l’atteinte des marges de section apparaît comme le principal facteur de risque de lésion résiduelle. Sa fréquence varie en fonction de la profondeur de l’exérèse et de la sévérité de la lésion initiale entre 5 et 51 % pour les CAD. Le diagnostic de résection incomplète n’équivaut pas à celui de lésions résiduelles (11-13,17,19-21). Les 0,4 à 11 % de lésions résiduelles découvertes après une exérèse estimée complète peuvent s’expliquer par les effets tissulaires de l’anse électrique aux limites de la pièce de résection pouvant gêner l’interprétation, par la fragmentation excessive de la pièce opératoire et par un nombre insuffisant de blocs analysés. À l’inverse, l’absence de lésion résiduelle observée dans 17 à 87 % des cas avec des marges non saines s’explique par les effets tissulaires induits par l’anse électrique ou par le processus de cicatrisation pouvant modifier l’histoire naturelle d’une petite lésion résiduelle. Des cancers ont été découverts entre 3 mois et 5 ans après le traitement de CIN(24-26). Leur fréquence est estimée entre 1 et 2 ‰ lésions traitées( 25,26). Ils sont liés au soustraitement d’un cancer méconnu ou à la progression d’une lésion résiduelle ou d’une récidive. Dans une analyse de la littérature portant sur 26 cohortes, avec au total plus de 500 000 années/femmes), l’incidence du cancer du col après un traitement de CIN est estimée à 56/100 000 années/femmes. Il s’agit d’une incidence 3 à 4 fois supérieure à celle observée pour une population témoin, persistante pendant les 20 ans qui suivent le traitement de la CIN même s’il s’agit d’une hystérectomie (18). La conisation à l’anse diathermique permet d’obtenir des taux de guérisons entre 83 et 96 %. L’atteinte des marges de section apparaît comme le principal facteur de risque de lésion résiduelle, mais le diagnostic de résection incomplète n’équivaut pas à celui de lésions résiduelles. Les complications thérapeutiques Parmi les complications immédiates figurent les hémorragies et les infections. Les saignements sont généralement de faible abondance après un traitement destructeur. Ces saignements se manifestent durant la phase de cicatrisation pendant 4 à 10 jours et ne nécessitent aucun traitement particulier. Les hémorragies per- et postopératoires sévères sont plus rares pour les conisations au laser (1,7 %) et les CAD (1,3 %) que pour les conisations au bistouri froid (4,6 %)(22). Les infections pelviennes sont exceptionnelles. Même si le traitement est réalisé avec le souci de la conservation d’un maximum d’épithélium et de stroma normaux pour préserver la fonction du col, les risques de séquelles fonctionnelles postthérapeutiques existent quelle que soit la méthode de traitement. Ces séquelles sont particulièrement préoccupantes chez les femmes jeunes, désireuses de grossesse. Parmi les séquelles thérapeutiques, les sténoses peuvent être responsables de troubles menstruels, entraîner une infertilité, avoir des répercussions sur le déroulement de la grossesse et l’accouchement, et gêner la surveillance post-thérapeutique. Il est difficile de comparer les fréquences des sténoses post-thérapeutiques parce que les définitions varient énormément d’une étude à l’autre, que le recul postthérapeutique est souvent court et que la colposcopie n’est pas toujours systématique après le traitement. Dans la littérature, les fréquences varient, selon la sévérité des lésions traitées, la profondeur de l’exérèse, l’âge des patientes et les modalités de la surveillance post-thérapeutique, entre 1,3 et 5,2 % pour les résections à l’anse diathermique (2, 8, 25). Une métaanalyse récente porte sur les conséquences obstétricales du traitement des CIN(28). La vaporisation du col utérin ne semble pas augmenter le risque d’avortements et d’accouchements prématurés, à l’inverse de la conisation à l’anse diathermique. Toutefois, on ne note pas d’augmentation significative du risque d’accouchements prématurés si la profondeur de la conisation à l’anse diathermique est inférieure à 10 mm. Le choix de la méthode et de l’étendue du traitement doit être fait avec le double souci de l’efficacité et de la moindre iatrogénie. Le traitement destructeur ou l’exérèse doivent déborder, avec une marge de sécurité d’environ 3 mm les limites de la lésion. Dans la littérature, on ne note pas d’augmentation significative du risque d’accouchements prématurés si la profondeur de la conisation à l’anse diathermique est inférieure à 10 mm. La surveillance postopératoire La surveillance des patientes traitées pour une CIN de haut grade doit permettre la détection des lésions résiduelles et récurrentes à partir desquelles un cancer est susceptible de se développer. Ces lésions surviennent en général dans les premières années postopératoires (13,19). Les modalités de surveillance postopératoire des CIN doivent tenir compte de la sensibilité imparfaite du frottis et de la colposcopie postopératoires, et du risque d’abandon de la surveillance, qui augmente avec le délai postopératoire. En cas de traitement par destruction ou d’exérèse complète, un premier contrôle est proposé 3 à 6 mois après le traitement. Compte tenu de la sensibilité imparfaite de la cytologie, ce contrôle devrait associer la colposcopie et le frottis. Des biopsies dirigées et/ou un curetage endocervical sont à faire selon l’aspect colposcopique et la situation de la jonction squamo-cylindrique. Les examens normaux méritent d’être répétés dans un délai de 6 mois à 1 an, avant d’envisager une surveillance cytologique annuelle pendant 20 ans. L’intérêt de la détection du DNA de l’HPV dans la surveillance post-thérapeutique des CIN a fait l’objet de plusieurs études récentes. La sensibilité de la détection virale pour le diagnostic des lésions résiduelles est très bonne, variant de 92 % à 100 %, mais la spécificité est faible (44 % à 86 %). Pour de nombreux auteurs, la bonne sensiblité et la valeur prédictive négative très élevée du test HPV devraient permettre de simplifier la surveillance post-thérapeutique avec une proposition de retour à un dépistage classique en cas de frottis sans anomalie cytologique associé à la non-détection de DNA d’HPV oncogènes après le traitement. Pour la surveillance des patientes traitées pour une CIN de haut grade, il convient de proposer un frottis annuel pendant 20 ans. POINTS À RETENIR Les CIN de haut grade sont des lésions asymptomatiques de fréquence croissante et survenant chez des femmes de plus en plus jeunes. L’histoire naturelle des CIN est de mieux en mieux connue, mais individuellement, il est impossible de prédire l’évolution d’une lésion et de prévoir la durée réelle de la phase pré-invasive en cas de progression. Le traitement des CIN de haut grade permet, dans la grande majorité des cas, de prévenir le développement ultérieur d’un cancer invasif, mais la possibilité d’une lésion résiduelle ou récidivante impose une surveillance prolongée.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :