Publié le 05 sep 2006Lecture 18 min
THS et cancer du sein La dictature de la médecine basée sur les preuves
B. TOURNANT Centre des Maladies du Sein, Hôpital Saint-Louis, Paris
En se limitant strictement au traitement hormonal substitutif de la ménopause (THS) et au cancer du sein (CS) et en excluant l’impact du THS sur la densité mammaire, nous essayerons de répondre à 3 questions : THS et risque de CS : existe-t-il une vérité ? THS et type de CS : y a-t-il une différence ? THS après CS : est-ce possible ?
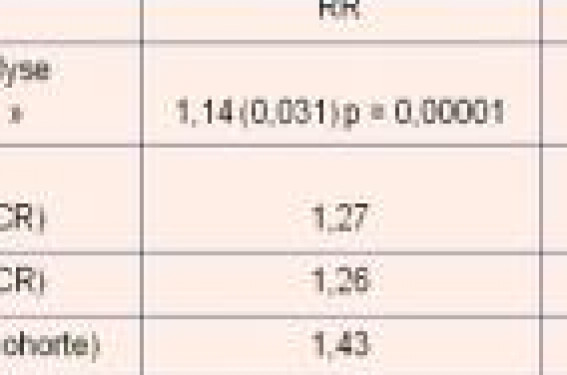
THS et risque de cancer du sein Depuis la fin des années 1990, les résultats de 5 grandes études épidémiologiques prospectives ont été publiés et essayant de répondre à la question(1-8). L’augmentation du risque relatif Il ressort de ces 5 grandes études très hétérogènes (métaanalyse, essais contrôlés randomisés, cohortes) une indiscutable vérité : il existe un sur-risque de cancer du sein (CS) associé à la prise de THS (tableau 1, p.3). Cependant, analysées individuellement, ces études ont des particularités qui leur sont propres et des vérités contradictoires et cette notion d’augmentation du risque relatif doit être tempérée et nuancée. Qu’en est-il du risque absolu ? Il est certainement plus explicite de parler en risque absolu qu’en risque relatif. > Ainsi, dans l’étude WHI, après 5,2 années de traitement, les auteurs ont conclu qu’il y avait 8 cas supplémentaires de cancer du sein pour 10 000 femmes traitées, soit une augmentation de 0,08 %. > En France, sur 100 femmes ménopausées de 50-70 ans, 4,5 développeront spontanément un cancer du sein sur une période de 20 ans. Avec un THS, ECE + MPA, (estrogènes conjugués équins + acétate de médroxyprogestérone) suivi pendant 5 ans, 4,7 présenteront un cancer du sein sur la même période de 20 ans. La surestimation globale du risque de cancer du sein est estimée à 2 pour 1 000 années/ femmes, selon la majorité des publications (en dehors de la MWS où il est estimé à 2,8…, à condition que ce risque soit constant ce qui est certainement loin d’être le cas. Évolution des autres facteurs de risque Il convient de comparer l’augmentation du risque relatif sous THS à celle liée à d’autres facteurs de risque reconnus de cancer du sein (tableau 2). Concernant l’âge, dans 2 études (HERS et WHI), il faut noter que l’âge moyen des femmes est respectivement de 67 et 63 ans et que le traitement a été réintroduit dans un délai moyen depuis la ménopause respectivement de 18 et 15 ans… et l’on sait que le risque de cancer du sein augmente avec l’âge. Un THS prescrit à 50 ans n’a peut-être pas les mêmes effets qu’un THS prescrit à 65 ans. L’obésité dans la WHI est déjà un facteur significatif de risque de cancer du sein chez les femmes qui n’utilisent pas de THS, avec un risque relatif à 2,52 (IC 95 % [1,62-3,93]), mais on ne sait pas comment ce facteur « obésité » intervient chez les femmes traitées. Impact du THS antérieur Dans l’étude WHI, l’augmentation du risque de cancer du sein observé concerne essentiellement les femmes ayant pris un THS préalablement à leur inclusion dans l’étude, soit 26 % des femmes : c’est-à-dire que pour près de 75 % des femmes traitées dans l’étude, il n’y a pas d’augmentation du risque. – En l’absence d’utilisation antérieure, HR (relative ligand) = 1,06 [0,81-1,38] pour 3 à 7 ans d’utilisation de THS dans l’étude. – En cas de prise antérieure de moins de 5 ans : HR = 2,13 [1,15-3,94]. – Pour 5 à 10 ans d’utilisation antérieure : HR = 4,61 [1,01-21,02]. – Pour 10 ans et plus, HR = 1,81 [0,60-5,43] et n’était donc plus significatif. Cependant, les effectifs étaient faibles dans chacun de ces sous-groupes. Dans la MWS, il n’est pas retrouvé d’augmentation du risque en cas d’utilisation antérieure de THS. Dans l’étude française E3N, les femmes ayant utilisé antérieurement un THS ont été exclues de l’étude. Si ces 10 869 femmes exclues sont prises en compte dans l’analyse, les résultats ne mettent pas en évidence d’augmentation significative du risque de cancer du sein sous THS associant estrogènes et progestatifs synthétiques (RR plus faibles, tous proches de 1 et sans atteindre la significativité). Les résultats observés avec les estrogènes seuls ou associés à la progestérone micronisée demeurent, quant à eux, inchangés. Impact de la durée Dans la métaanalyse d’Oxford, le risque global toutes utilisatrices est de 1,14, variant avec la durée d’utilisation avec : – RR = 1,31 pour 5 à 9 ans de traitement, – RR = 1,24 pour 10 à 14 ans de traitement, – RR = 1,5 pour 15 ans de traitement. Cette métaanalyse montre également que l’élévation du risque disparaît à l’arrêt du THS, ce qui est en faveur d’un effet promoteur du THS. Dans la WHI, il était mis en avant un effet durée du THS lors de la publication de 2002 qui n’a pas été significativement confirmé lors de la publication 2003, sur le cancer du sein (p = 0,15). Dans la MWS, les cancers du sein ont été en moyenne diagnostiqués 1,2 an après l’inclusion : il s’agissait donc de cancers préexistants à l’étude. Concernant les estroprogestatifs, les auteurs retrouvent un effet durée avec un RR à 2,21 [2,06-2,36] pour plus de 5 ans d’utilisation. Avec les estrogènes seuls, le RR passe de 1,21 [1,07-1,37] à moins de 5 ans d’utilisation à 1,34 [1,23-1,40] à plus de 5 ans d’utilisation. Par ailleurs, c’est la seule étude à trouver, en dehors de tout THS, un risque de cancer du sein plus élevé en préménopause qu’en postménopause… alors que l’incidence de cancer du sein augmente avec l’âge ! L’étude E3N, si l’on considère la durée d’exposition au THS, ne met en évidence une augmentation du risque de CS qu’avec les THS associant estrogènes oraux et progestatifs synthétiques, c’est-à-dire essentiellement MPA et CPA – (acétate de cyprotérone) et, à un moindre degré, NETA (acétate de norethistérone) ; l’augmentation est significative pour les durées d’utilisation >= 2 ans : – RR = 1,6 [1,1-2,3] pour des durées d’exposition de 2 à 4 ans, – RR = 1,9 [1,2-3,2] pour des durées d’exposition >= à 4 ans. En revanche, cette étude ne met pas vraiment en évidence d’effet durée avec le THS associant estrogènes cutanés et progestatifs dérivés de la progestérone (autres que MPA, CPA et dérivés de la 19 nortestostérone). L’augmentation du risque n’est en effet significative que pour les courtes durées d’exposition (< 2 ans) : RR 1,6 [1,3-2,0] et la significativité disparaît pour les durées supérieures à 2 ans ! Cela paraît en faveur de l’existence de tumeurs infracliniques préexistantes à la prise de THS. Impact du type de THS Dans le bras « estrogènes seuls »(6) de l’étude WHI, (c’est-à-dire chez les femmes ayant eu une hystérectomie), contrairement au groupe estroprogestatif, il n’a pas été observé d’excès de cancer du sein après 6,8 ans de recul, mais au contraire une tendance (à la limite de la significativité) à une diminution du risque avec un HR à 0,77 [0,59-1,01]. La MWS est en contradiction avec la WHI et avec les publications antérieures qui, dans leur très grande majorité, ne retrouvaient pas d’augmentation du risque liée à leur utilisation seule. Les auteurs de la MWS retrouvent, en effet, une augmentation du risque avec un RR à 1,3 (1,22-1,38). Ce risque est le même, quels que soient la dose et le type d’estrogènes (ECE ou estradiol) et quelles que soient les modalités d’administration orales ou transcutanées. Dans l’étude française E3N, le risque relatif lié à l’utilisation d’estrogènes seuls est de 1,1 [0,8-1,6], ce qui n’est pas significatif. Estroprogestatifs Globalement, toutes les études montrent un risque plus élevé avec estroprogestatifs qu’avec estrogènes seuls. Dans la MWS pour les progestatifs utilisés en association avec les estrogènes, aucune différence n’est retrouvée entre l’acétate de médroxyprogestérone (MPA), la norethistérone, le nor-lévonorgestrel. Le risque est également le même en cas d’administration séquentielle ou continue. Dans l’étude E3N, il n’y a pas d’augmentation significative du risque avec les THS associant des estrogènes (cutanés) et la progestérone micronisée (RR = 0,9 [0,7-1,2]), mais il existe une augmentation significative chez les utilisatrices associant des estrogènes (cutanés ou oraux) et un progestatif de synthèse (RR = 1,4 [1,2-1,7]). Ainsi, l’augmentation du risque de cancer du sein paraît limitée au THS contenant des progestatifs synthétiques. E3N est la première étude mettant en évidence que les THS associant estrogènes et progestérone micronisée paraissent ne pas augmenter le risque de cancer du sein. Pronostic des cancers du sein sous THS Mortalité La plupart des études rapportent un risque plutôt diminué pour les femmes sous THS(9), avec, globalement, environ 20 à 30 % de réduction de mortalité par cancer du sein. Dans la WHI, il n’a pas été observé de différence de mortalité par cancer du sein entre les deux groupes. La seule étude qui retrouve un risque augmenté de décès par cancer du sein, pour les femmes encore sous THS au moment du diagnostic, est celle de la MWS (RR = 1,22 [1,05-1,41])…, mais la surmortalité est peut-être ici simplement due au plus grand nombre de cancers du sein. Par ailleurs, dans cette étude, manifestement, des femmes préalablement atteintes d’un cancer du sein ont été incluses dans le groupe des cancers apparus sous THS. Une étude récente(10) semble montrer que l’amélioration pronostique et l’évolution des cancers diagnostiqués en cours de THS, sont en rapport avec une médicalisation plus importante des femmes, mais sont aussi secondaires à un effet direct des hormones. Une métaanalyse américaine(11) de 30 études conclut que le THS entraîne une diminution (39 %) de la mortalité chez les femmes ménopausées, traitées jeunes jusqu’à l’âge de 60 ans (17 études). Chez les femmes plus âgées (au-delà de 60 ans), il n’y a pas de différence significative de la mortalité globale chez les femmes traitées ou non traitées (13 études). Cas des femmes BRCA 1 ou 2 Qu’en est-il du rapport bénéfice/ risque du THS chez les femmes porteuses d’une mutation BRCA 1 ou 2 (qui ont un risque majeur de cancer du sein et/ou de l’ovaire), s’il leur est proposé un THS après ovariectomie prophylactique ? Une étude analytique récente(12) a essayé de répondre à cette question et retrouve un effet global du THS n’altérant pas l’espérance de vie après ovariectomie prophylactique. Cet effet dépend de la durée d’utilisation du THS, de l’âge de l’ovariectomie et de la réalisation ou non d’une mastectomie prophylactique. Une femme mutée BRCA ayant une ovariectomie sans mastectomie à 30, 35 ou 40 ans avec THS jusqu’à 50 ans aura respectivement une espérance de vie très légèrement diminuée à 30 ans (- 0,34 ans), pas de changement à 35 ans, et un gain modéré à 40 ans (+ 0,17 an). Si chez ces mêmes femmes, le THS est utilisé à vie, il existe une diminution de l’espérance de vie de - 1,09 (chirurgie à 30 ans) à - 0,79 ans (chirurgie à 40 ans). En revanche, en cas de mastectomie en plus de l’ovariectomie, le THS arrêté à 50 ans ou à vie apporte un gain croissant de l’espérance de vie. THS et type de cancer du sein Plus d’une trentaine d’études ont comparé les caractéristiques des cancers du sein apparaissant sous THS, à celles des cancers du sein des femmes ne prenant pas de THS. Toutes ces études sont également très hétérogènes et parfois contradictoires depuis les études rétrospectives d’observation, jusqu’aux essais randomisés(13). Des caractéristiques plus favorables La plupart de ces études semble néanmoins confirmer la plus grande fréquence de caractéristiques cliniques et histologiques favorables chez les femmes ayant reçu un THS, comparativement à celles n’en ayant pas reçu : tailles clinique et histologique plus petites, grade histopronostique de Scarff-Bloom-Richardson (SBR) plus favorable, envahissement ganglionnaire moindre, stades moins avancés. Parmi les études les plus récentes publiées en 2003, celles de Kerlikowske(14), de Gertig(15) ou de Cutuli(16) montrent soit pas de différence, soit un effet favorable du THS quant à la taille, au grade histopronostique, à l’envahissement ganglionnaire et au stade. Déjà, dans la métaanalyse de 1997(1), qui regroupait 51 études, les cancers diagnostiqués sous THS l’étaient à un stade plus précoce. L’exception de la WHI Ces données vont cependant à l’encontre des résultats de l’étude randomisée WHI(5). En effet, pour cet essai américain, le diamètre moyen des cancers invasifs sous THS est de 1,7 cm contre 1,5 cm pour le groupe placebo (p = 0,04), le taux d’envahissement ganglionnaire plus important pour les cancers sous THS : 26,9 % versus 15,8 % (p = 0,03) pour le groupe témoin et il y a plus de stades avancés (extension régionale ou métastatique) parmi les cas sous THS, que dans le groupe témoin : 25,4 % versus 16 % (p = 0,04). Cette étude est toutefois critiquable sur le plan méthodologique : – population âgée (63 ans en moyenne avec 21 % de plus de 70 ans !) dont 26 % avaient reçu antérieurement un THS (8 % pour une durée supérieure à 5 ans) ; – délai d’introduction du THS depuis la ménopause d’environ 15 ans ; – produits utilisés (ECE + MPA) ne correspondant pas à ceux utilisés en France ; – enfin, 42 % des patientes sous THS dans l’étude WHI ont abandonné leur traitement et les modalités de leur suivi ultérieur sont inconnus. L’augmentation de taille constatée (1,7 versus 1,5 cm, p = 0,04) n’a pas de valeur pronostique et la manière dont les cancers ont été mesurés n’est pas précisée : taille clinique, mammographique ou histologique ? On peut également s’étonner que, dans une étude où un examen clinique et une mammographie étaient pratiqués tous les ans, on ait retrouvé des cancers de plus de 5 cm. Sur les 49 cas de cancers invasifs de l’étude, la tumeur s’accompagnait d’un envahissement ganglionnaire dans 45 cas, contre 21 sous placebo, mais dans plus de 12 % des cas, le statut ganglionnaire n’est pas précisé… C’est la seule étude qui montre des tumeurs avec un envahissement ganglionnaire plus important. Par ailleurs, en ce qui concerne les métastases, il y a eu 1 % de survenues de métastases sous THS versus 2 % sous placebo. Cette étude WHI ne semble pas être transposable à la population française, car les taux de cancers du sein dans cette population américaine âgée et plus obèse sont plus élevés que ceux de la population française généralement traitée (tranche d’âge de 50-60 ans). Par ailleurs, l’introduction tardive d’un traitement hormonal agit peut-être autrement qu’un traitement prescrit dans la continuité de l’activité ovarienne physiologique. Les récepteurs hormonaux Concernant les récepteurs hormonaux (RH), dans la très grande majorité des études, il n’y a pas de différence significative entre les cancers avec et sans THS. Kerlikowske(14) retrouve cependant un taux plus élevé de récepteurs aux estrogènes chez les femmes sous THS estroprogestatifs et Li(17) note également un taux de récepteurs aux estrogènes et à la progestérone plus élevés avec les THS combinés. Le type histologique Dans l’étude WHI, il n’a pas été observé d’excès de cancers du sein in situ dans le bras traité, ce qui peut signifier que le THS n’a pas entraîné d’accélération de la croissance d’états précancéreux et n’a donc probablement pas d’effet « initiateur » dans la carcinogenèse. Cependant, d’autres études(18,19) notent une augmentation du nombre de cancers canalaires in situ (Cheek 16 % versus 9 %, Pappo 20 % versus 17 %), et Ross sous estrogènes seuls retrouve un OR à 1,41. Le risque de cancers lobulaires invasifs apparaît augmenté dans plusieurs études, comparativement aux cancers canalaires(17,18,20,21,22). Cette augmentation est plus marquée avec les THS combinés estrogènes/progestatifs qu’avec les estrogènes seuls, et ce risque serait plus élevé avec la durée du traitement. Pour Dailing JR(22) et Weiss LK(23), études cas/témoins, le risque de cancers lobulaires est plus élevé avec les THS combinés estroprogestatifs et continus qu’avec les séquentiels. Étant donné que les cancers lobulaires sont souvent plus hormono-dépendants (récepteurs hormonaux positifs plus souvent), ils seraient peut-être plus sensibles à la stimulation hormonale ou se « réveilleraient » peut-être plus souvent avec cette réintroduction hormonale…, mais ils ont généralement la réputation d’être de meilleur pronostic en termes de survie. THS après cancer du sein Le THS des femmes ayant eu un cancer du sein est controversé. Il est classiquement contre-indiqué, la notion de risque carcinologique étant très ancrée dans la population féminine… et surtout dans la population médicale. Une vingtaine d’études ont été publiées à ce jour sur le sujet. Il s’agit essentiellement d’études observationnelles non contrôlées et rétrospectives et d’études cas/témoins ; très peu d’études randomisées(24-26) ont été rapportées, en grande partie en raison des difficultés à les mener. Les données rassurantes Globalement, ces études ne paraissent pas défavorables au THS. Les taux de rechutes sont peu ou pas différents concernant les femmes traitées, comparativement aux non-traitées (7 % environ). Mais la stadification du cancer, le statut ganglionnaire ou des récepteurs hormonaux, les composés hormonaux et leurs doses sont très variables d’une étude à l’autre, et il est difficile de les comparer. L’étude française de A. Gorins et coll.(27), étude prospective de 230 patientes avec cas/témoins, comme les études cas/témoins de Eden(28), Disaïa(29), Beckman(30) ou O’Meara(31) concluent à l’absence d’augmentation des rechutes et des décès sous THS. Dans cette étude française, l’atteinte ganglionnaire et une prise trop précoce après le traitement du cancer du sein (< 3 ans) semblent des facteurs favorisants de rechute, alors que le statut des récepteurs hormonaux ne paraît pas discriminatif. La métaanalyse de Col NF.(32) conclut à un effet non délétère du THS chez les femmes ayant été atteintes d’un cancer du sein. Dans un essai randomisé à base d’estrogènes équins seuls, pour Wassilopoulou-Sellin R.(24), le THS ne semble pas compromettre la survie des patientes ayant eu un cancer du sein et n’augmente pas le risque de rechutes ou de second cancer et plus particulièrement chez les patientes RH négatif. Mais… Mais l’HABITS Trial et le Stockholm trial(26) sont venus jeter le trouble ! L’essai HABITS L’essai HABITS randomisé a été initié en Mai 1997 ; 434 femmes ont été randomisées (sur 1 300 prévues initialement) jusqu’en Septembre 2003 et 345 ont pu être suivies et analysées. Avec un recul médian de 2,1 ans, le nombre d’évènements (rechutes locales, cancer controlatéral et évolution métastatique) était augmenté dans le groupe traité : RR = 3,3 [1,5-7,4], comparativement au groupe non-traité et l’essai a été interrompu en Décembre 2003. L’analyse selon l’expression des récepteurs hormonaux montre un risque relatif de 4,8 [1,1-21,4] en cas de récepteurs positifs et de 1,9 [0,4-9,6] pour les récepteurs négatifs. Cependant, il faut noter que les RH étaient positifs chez 56 % dans le bras THS contre 48 % dans l’autre bras et 21 % des patientes étaient sous tamoxifène dans les deux bras… L’analyse du Stockholm trial L’analyse préliminaire du Stockholm trial a, lui, montré un RR de 0,82 [0,35-1,89] et cet essai a été arrêté prématurément en raison de difficulté de recrutement et de compliance, sans que cette différence entre ces deux essais scandinaves soit expliquée par les auteurs. Tout cela n’autorise donc pas à modifier l’attitude de prudence à l’égard du THS après cancer du sein. Si certaines études sont rassurantes, il paraît raisonnable de rester réservé, étant donné le nombre de cas publiés encore relativement restreint, le manque de recul dans le temps et d’homogénéité des études. Conclusion Toutes ces contradictions d’études épidémiologiques, les recommandations qui en ont découlé et leurs traductions dans les médias sont autant de contraintes qu’il nous faut cependant expliquer à nos patientes. En effet, conformément à la loi du 4 mars 2002 relative aux droits des malades et à la qualité des soins, toute femme qui consulte pour un THS a le droit d’être informée sur son état de santé, sur le traitement proposé, son utilité, ses conséquences et les risques fréquents et graves normalement prévisibles qu’il comporte. Nous avons donc le devoir d’information, mais ces contraintes ne doivent cependant pas se transformer en diktat… Par ailleurs • Aucune étude n’a actuellement montré que le THS pouvait être initiateur de cancer du sein. • En dehors de la MWS, étude particulièrement critiquable, aucune autre étude n’a montré d’augmentation de la mortalité par cancer du sein avec le THS. • En France, 1 femme sur 3 à 4 décède d’une pathologie cardiaque et/ou vasculaire contre 1 sur 25 d’un cancer du sein… et quand on interroge les cardiologues sur la hausse du risque cardiovasculaire après la ménopause, l’hypothèse la plus probable qu’ils émettent est une modification de plusieurs paramètres, consécutive à la forte diminution des estrogènes…
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :