Publié le 12 oct 2008Lecture 10 min
Qu’est-ce qu’une femme à risque génétique de cancer du sein ?
P. VENNIN, C. ADENIS, Centre Oscar Lambret, Lille
Toutes les femmes ne sont pas confrontées à un risque équivalent de cancer du sein. Les cancers du sein sont des processus multifactoriels complexes, parmi lesquels se trouvent des « facteurs » génétiques. Les études de cohortes de jumeaux laissent supposer que des facteurs transmissibles interviennent dans 25 % des cas de cancers du sein.
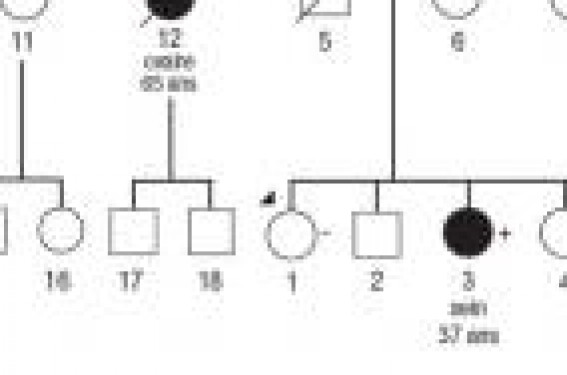
Le risque génétique de cancer du sein Parmi les « facteurs » transmissibles, certains ont une pénétrance (c’est-à-dire un risque d’atteinte) très forte (BRCA1, BRCA2, p53, PTEN, CDH1), et d’autres plus modérée (ATM, CHECK2, PALB2). Les allèles de très forte pénétrance sont rares en population générale (moins de 1 % des femmes). Les moins rares concernent BRCA1 et BRCA2, dont les défauts de séquence rendent compte d’environ 5 % des cancers du sein. On commence par ailleurs à entrevoir, par l’étude de l’ensemble du génome humain (Genome Wide Studies), des polymorphismes très fréquents associés à des risques faibles (risque relatif de 2, par exemple). BRCA1 et BRCA2 En pratique en 2008, le risque génétique de cancer du sein se résume aux mutations délétères sur deux gènes normaux, BRCA1 et BRCA2 (BReast CAncer 1 et 2). Les autres situations (Li-Fraumeni [p53], maladie de Cowden [PTEN], association cancer du sein lobulaire et cancer diffus de l’estomac [CDH1]) sont exceptionnelles. Les mutations de BRCA1 et BRCA2 sont associées à la grande majorité des hérédités sein/ovaire et peut-être à la moitié des hérédités de cancers du sein seul. Cela ne signifie cependant pas que l’anomalie génétique sera identifiée dans cette proportion en raison de la sensibilité incomplète des analyses moléculaires actuelles et de l’hétérogénéité génétique. Globalement, en France, le taux de détection des mutations parmi les familles testées se situe un peu en dessous de 20 %, ce qui signifie qu’aucune « explication » n’est retrouvée pour la majorité des familles testées. Quel risque de cancer du sein ? Le « risque génétique » est donc la transmission possible de génération en génération, par le père ou la mère, avec une probabilité de 50 %, d’une anomalie de séquence sur l’un de ces deux gènes. Cette anomalie de séquence est associée à un risque majeur de développer un cancer du sein ou de l’ovaire chez la femme. Le risque cumulatif de cancer du sein est estimé entre 60 et 90 % pour la vie entière pour BRCA1 et BRCA2. Le risque devient significatif à partir de 30 ans. Le risque de cancer de l’ovaire pour la vie entière est d’environ 30-40 % pour BRCA1 et 10-20 % pour BRCA2. Il devient significatif à partir de 40 (BRCA1) ou 50 ans (BRCA2). Certaines mutations (particulièrement sur BRCA2) sont associées à des risques faibles d’autres cancers (cancer du sein chez l’homme, pancréas, prostate). L’arbre généalogique Concrètement, la première étape est celle de la construction de l’arbre généalogique de la famille. Les informations sur la localisation tumorale, l’âge de survenue, le nombre de cancers vont permettre d’estimer la probabilité dans la famille de mutation BRCA1/2. Plusieurs modèles sont disponibles pour calculer cette probabilité (BRCAPRO, Manchester, Tyrer- Cuzick, BOADICEA). Entre ces modèles, notre préférence va actuellement au score de Manchester qui est d’application simple et ne nécessite pas d’avoir auparavant entré la généalogie dans un logiciel. HÉRÉDITAIRE OU GÉNÉTIQUE ? Un risque héréditaire est documenté par l’arbre généalogique. L’hérédité relève donc de la clinique, la génétique de la biologie. Une femme à risque génétique de cancer du sein « possède », dans ses gènes, une « anomalie » qui lui a été transmise, qu’elle peut à nouveau transmettre et qui la prédispose à un risque élevé de cancer du sein. De toute manière, les estimations données par ces modèles sont à adapter en fonction d’autres éléments cliniques comme la taille de la famille, le ratio hommes/femmes, les histologies (basal pour le sein), l’origine (Ashkénaze, Pologne), en fonction des conséquences du test pour la famille et en fonction bien évidemment de la demande de la consultante. Les analyses moléculaires restent complexes, longues et coûteuses. L’usage actuel est d’envisager ces analyses lorsque la probabilité d’identifier une mutation délétère dépasse 10 %. Assez régulièrement, les biologistes identifient des mutations dites « variants non classés », dont la signification n’est pas connue et qui ne permettent pas de test prédictif. Syndrome sein-ovaire typique hérédité dorigine paternelle (Centre Oscar Lambret 2008) La loi Attention, selon la loi française, lorsqu’il s’agit d’un test prédictif, cette prise de sang ne peut être faite qu’après un consentement écrit de la personne prélevée et après les explications nécessaires pour comprendre ses objectifs. Une attestation d’information de la personne testée est délivrée par le prescripteur, destinée au praticien qui fait l’analyse moléculaire. Les informations concernent les caractéristiques de la maladie recherchée, les moyens de la détecter, les possibilités de prévention et de traitement. Cette activité d’oncogénétique se situe, bien sûr, dans un contexte médical pluridisciplinaire (biologiste, oncogénéticien, gynécologue, oncologue, psychologue, radiologue, chirurgien). Le test prédictif Lorsqu’une mutation délétère a été identifiée dans une famille, un test prédictif peut être réalisé chez les apparentés qui le souhaitent. Le résultat est disponible en quelques semaines alors que l’analyse initiale nécessite entre 6 et 12 mois actuellement. Deux prélèvements indépendants sont recommandés. Que faire avec ce resultat ? Les femmes qui n’ont pas hérité de la mutation délétère familiale ont en principe le risque habituel de cancer du sein et d’ovaire. Les femmes qui ont la mutation sont donc confrontées à un risque majeur de cancer du sein et d’ovaire. Que faire dans ce cas ? Bien sûr, chaque cas est particulier, mais le choix se fait schématiquement entre prévention et dépistage. Pour le risque de cancer de l'ovaire, compte tenu des limites du dépistage, de la gravité de la maladie, de la possibilité d’un traitement substitutif et d’une prévention chirurgicale très efficace (sauf le risque résiduel de cancer péritonéal), l’orientation se fait vers la chirurgie annexielle ou utéro-annexielle. La discussion porte sur le mo-ment de l’intervention pour les femmes qui ne sont pas ménopausées, en particulier en cas d’antécédent de cancer du sein qui contreindique l’utilisation des estroprogestatifs. L’ovariectomie avant la ménopause diminue vraisemblablement le risque de cancer du sein, surtout pour les mutations situées sur BRCA2. Pour le risque de cancer du sein, le choix se situe entre prévention et dépistage. La mastectomie bilatérale préventive associée à une reconstruction immédiate gomme pratiquement le risque de cancer du sein. Le dépistage organisé commence généralement vers l’âge de 30 ans avec, comme examen de référence, l’IRM annuelle, l’échographie et la mammographie venant essentiellement en complément lorsqu’une prise de contraste est identifiée, ce qui survient dans 10 à 20 % des cas. Cette IRM doit être réalisée par des radiologues rompus à cet examen avec possibilité de biopsie sous IRM pour les prises de contraste suspectes sans anomalie en imagerie traditionnelle. Bien entendu, ce dépistage n’est pas une garantie d’identification d’un cancer précoce, en particulier pour les tumeurs liées à BRCA1 qui ont un temps de doublement rapide. Le choix entre chirurgie préventive et dépistage est une décision très difficile qui progresse après les consultations d’oncogénétique, de chirurgie plastique, de psychologie, de gynécologie. Si le choix de la mastectomie bilatérale préventive reste minoritaire (moins de 10 % en France), la proportion de femmes qui optent pour ce geste est extrêmement variable selon les pays. Il est vraisemblable qu’interviennent des facteurs culturels, mais aussi le discours médical. Plus que jamais, les médecins ont ici un rôle d’information pour parvenir à un choix personnel éclairé. L’attitude pratique est donc très variable en fonction de multiples paramètres qui tiennent à la famille (type de cancer, âge de survenue, gravité, etc.) et à la personne (âge, situation familiale, préférences personnelles, antécédents, etc.). CRITÈRES D’INCLUSION POUR LA CONSULTATION D’ONCOGÉNÉTIQUE (LILLE 2008) 3 cas de cancer du sein appartenant à la même branche parentale et survenant chez des personnes unies entre elles par un lien de premier ou second degré, dont au moins un avant 50 ans. 2 cas de cancer du sein et/ou de l’ovaire chez des apparentées au premier degré, dont : – un cancer du sein avant 40 ans ; – un cancer du sein chez l’homme ; – un cancer de l’ovaire. 1 seul cas si : – cancer du sein bilatéral avant 40 ans ; – cancer du sein chez l’homme avant 60 ans ; – cancer de l’ovaire avant 60 ans ; – cancer du sein triple négatif avant 40 ans et demande de la patiente. Les cancers BRCA Lorsqu’ils surviennent, les cancers du sein liés à BRCA2 ne sont pas différents, au microscope, des cancers sporadiques. Les cancers du sein liés à BRCA1 sont le plus souvent de type basal (triple négatif) sans récepteurs aux estrogènes ou à la progestérone et sans surexpression d’HER2. Le quotidien Cependant, la majorité des situations rencontrées en consultation d’oncogénétique concerne des histoires familiales de cancer du sein sans mutation identifiée. Il est, dans ces cas, hasardeux d’estimer les risques personnels (les modèles, comme celui de Gail, disponible sur Internet [http://www.cancer.gov/bcrisktool/], sont performants pour estimer le risque d’une population, mais sont à manipuler avec d’infinies précautions à l’échelon de l’individu). Il faut se souvenir que le fait d’identifier un risque ne signifie pas qu’il y ait à la clé un dépistage efficace (la mammographie n’est pas un bon examen chez la femme jeune, le fait d’être en situation de risque élevé n’améliore pas sa sensibilité). Ne pas oublier enfin que toutes les interventions médicales ont des avantages et des inconvénients, les risques de faux positifs, de faux négatifs, de diagnostics en excès sont réels quel que soit l’examen. Les conséquences à long terme de l’irradiation du sein par les mammographies ne sont pas connues chez la femme jeune. Ces aspects ne doivent ni être écartés, ni minimisés. POINTS À RETENIR Le risque ne justifie pas en soi un dépistage. L’estimation d’un risque personnel est toujours hasardeuse. Toutes les interventions médicales ont des avantages et des inconvénients. EN PRATIQUE Savoir absolument repérer les familles sein-ovaire. « Techniquement » simple si une mutation délétère familiale est identifiée, on rassure les femmes qui n’ont pas la mutation, mais les autres sont face à un choix complexe et personnel, en particulier pour le risque mammaire. Savoir laisser le temps de la réflexion. Savoir expliquer nos incertitudes dans les familles à risque héréditaire lorsqu’il n’y a pas de mutation. Connaître les limites des examens de dépistage.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :