Publié le 12 fév 2008Lecture 11 min
Les métastases osseuses du cancer du sein
D. GRAHEK*, Ch. LE BRETON**, *Service de médecine nucléaire et centre TEP, hôpital Tenon, Paris **Service de radiologie, hôpital Tenon, Paris ; hôpital Raymond Poincaré, Garches
Les métastases osseuses peuvent être visualisées par différentes modalités d’imagerie. Cependant, l’évaluation de la réponse thérapeutique est difficile en imagerie. Actuellement, aucun critère n’est recommandé pour apprécier la réponse au traitement. L’IRM et la TEP-FDG, en cours d’évaluation dans cette indication, pourraient jouer un rôle important.
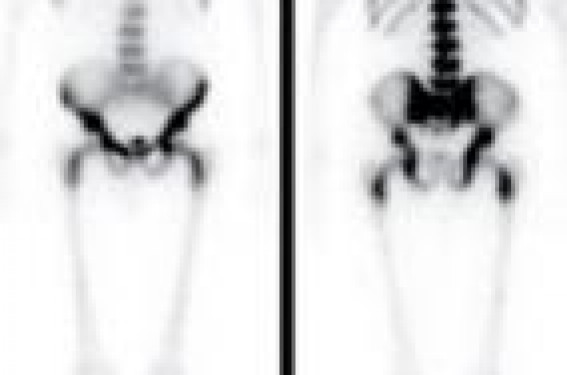
Merci au docteur Éric Zerbib (Val d’Or, Saint-Cloud) pour l’apport des iconographies de scintigraphie du squelette. Les métastases osseuses peuvent être visualisées par différentes modalités d’imagerie. Cependant, l’évaluation de la réponse thérapeutique est difficile en imagerie. Actuellement, aucun critère n’est recommandé pour apprécier la réponse au traitement. L’IRM et la TEP-FDG, en cours d’évaluation dans cette indication, pourraient jouer un rôle important. Le cancer du sein est l’un des cancers les plus ostéophiles et l’os est la localisation métastatique à distance la plus fréquente dans cette pathologie. Les métastases osseuses (MO) sont présentes dans 8 % de l’ensemble des cancers du sein, et dans 70 % des cas pour les stades avancés. Quinze pour cent des patientes avec au moins 4 métastases ganglionnaires axillaires auront des localisations secondaires os-seuses à 2 ans et 41 % à 10 ans. De même, 21 % des patientes auront des MO à 2 ans après une récidive locorégionale ou dans les tissus mous et 37 % à 10 ans. L’os est le seul site métastatique dans 20 % des cas. Les MO peuvent être asymptomatiques dans 30 % des cas, mais peuvent aussi être à l’origine de douleurs invalidantes et de complications à type de fracture ou de compression médullaire. Le diagnostic et le traitement des MO est par conséquent un élément primordial dans la prise en charge des patientes. Physiopathologie La dissémination osseuse se fait principalement par voie hématogène comparée à la voie lymphatique ou directe par contiguïté, plus rarement mise en cause. Les MO se localisent avec prédilection, mais non exclusivement, sur les segments squelettiques les plus richement vascularisés où siège la moelle hématopoïétique (squelette axial, extrémités supérieures des humérus, des fémurs et des tibias et gril costal chez l’adulte). Des localisations sur le squelette appendiculaire peuvent être facilitées par une conversion de la moelle adipocytaire en moelle hématopoïétique. Cette conversion est mise en œuvre lorsque la fonction hématopoïétique de la moelle est compromise par une infiltration tumorale, une radiothérapie ou une chimiothérapie ou l’administration de facteurs de croissance hématopoïétique. Enfin, l’os est un microenvironnement propice aux cellules cancéreuses par la production de facteurs de croissance tumorale et les cellules cancéreuses interagissent sur l’os par l’intermédiaire de médiateurs stimulant la résorption osseuse. Les remaniements osseux induits par les MO dans les cancers du sein peuvent avoir trois aspects radiologiques différents : lytique (50 % des cas), condensant (15 à 20 % des cas) ou mixte avec une composante ostéoblastique et ostéolytique. Imagerie diagnostique Le principe de la formation de l’image est différent selon les modalités d’imagerie. La scintigraphie osseuse permet de visualiser les cristaux d’hydroxyapatite en formation, la radiographie osseuse et la tomodensitométrie (TDM), la densité de l’os, l’imagerie par résonance magnétique (IRM), la composition cellulaire et la tomographie par émission de positons au fluorodésoxyglucose (TEP-FDG), le métabolisme glucidique des cellules. Parce que chaque modalité d’imagerie visualise des aspects différents ou des métabolismes différents du tissu osseux et de la moelle osseuse, la visualisation des lésions lytiques, blastiques ou mixtes sera dépendante de l’imagerie utilisée. La scintigraphie osseuse La scintigraphie osseuse (SO) met en évidence l’activité ostéoblastique de l’os et sa vascularisation, après injection intravasculaire d’un bisphosphonate marqué au technétium 99m. Les lésions osseuses s’accompagnent en général d’une augmentation de l’activité ostéoblastique, la-quelle est rendue visible par l’accumulation du traceur radioactif. Cet examen très sensible permet de détecter des MO avant l’apparition des anomalies radiologiques. En revanche, il manque de spécificité puisque la plupart des lésions osseuses bénignes ou malignes s’accompagnent d’une réaction ostéoblastique. Le contexte clinique doit, par conséquent, toujours être pris en compte dans l’interprétation. Si le diagnostic de MO dans un contexte de néoplasie ne fait aucun doute de-vant des hyperfixations multifocales distribuées de façon aléatoire et prédominant sur le squelette axial ou devant l’image d’un super bone scan (trop belle image du squelette axial avec disparition de la visualisation des membres et des reins, témoignant d’une infiltration métastatique os-seuse diffuse [figure 1]), l’interprétation d’un foyer d’hyperfixation isolé sans contexte traumatique est plus délicate et une imagerie complémentaire est nécessaire. Les performances de la SO sont variables d’une étude à l’autre, les sensibilités (Se) rapportées vont de 62 à 100 % et les spécificités (Sp) de 78 à 100 %. Figure 1. Image scintigraphique de super bone scan traduisant un envahissement métastatique osseux diffus. Les acquisitions tomographiques permettant une visualisation dans les 3 plans de l’espace et en mode 3D avec la fusion des images scintigraphiques et des images TDM acquises à l’aide de caméras hybrides augmentent la Se et la Sp de l’examen (figure 2). Figure 2. Hyperfixation d’une métastase rachidienne lytique visible dans les trois plans de l’espace en tomoscintigraphie et localisée avec précision par la fusion des images scintigraphiques et tomodensitométriques acquises en même temps sur une gamma-caméra hybride. La radiographie osseuse Sur les radiographies osseuses (RO), les MO apparaissent comme des zones de faible ou d’absence de densité osseuse pour les lésions lytiques ou de surdensité pour les lésions blastiques. Les anomalies radiologiques n’apparaissent que tardivement, après plusieurs mois d’évolution. En effet, la visualisation d’une lésion lytique nécessite la destruction de 40 à 50 % de l’os spongieux. La Se de la RO a été estimée entre 44 et 50 %. La RO ne sera demandée qu’en complément de la SO ou pour explorer une zone symptomatique. Elle permet, en outre, en cas d’hyperfixation pathologique isolée, de préciser un certain nombre de diagnostics différentiels ou d’orienter en fonction des signes radiologiques (asymétrie d’une vertèbre de face, disparition d’un pédicule, etc.) vers l’origine maligne d’un tassement vertébral (figure 3). Figure 3. Tassement vertébral métastatique de L3 d’aspect asymétrique sur la radiographie de face du rachis lombaire. La TDM Avec une très bonne résolution anatomique, la TDM permet une étude précise de la structure osseuse (figure 4). Figure 4. Métastase lytique du sternum avec une hyperdensité réactionnelle des parties molles en périphérie, visible sur une coupe sagittale en TDM. Sa sensibilité diagnostique varie de 71 à 100 % en fonction des études. La visualisation en mode 3D facilite l’analyse des structures osseuses et en particulier des côtes (figure 5). Figure 5. Visualisation d’une métastase costale lytique sur les images TDM en reconstruction 3D. Plusieurs diagnostics différentiels des MO peuvent être évoqués devant une lésion condensante (maladie de Paget), mixte (dysplasie fibreuse) ou lytique (granulome éosinophile) ; l’analyse précise de la structure osseuse en TDM ne permet pas toujours de porter un diagnostic précis et le recours à la biopsie peut être nécessaire. La TDM n’est pas recommandée de façon systématique pour la détection des MO, mais vient en complément de la SO ou des RO. En revanche, si une TDM du tronc est réalisée pour l’évaluation d’une tumeur, l’étude de l’examen en fenêtre osseuse s’impose. L’IRM La visualisation des MO en IRM est basée sur le déséquilibre induit dans la composition cellulaire de la moelle osseuse par la lésion tumorale. Elle permet la détection des lésions de la moelle osseuse avant toute atteinte de la structure osseuse. Sa sensibilité est, par conséquent, supérieure aux imageries précédemment décrites. Selon les études, elle varie de 82 à 100 % et sa spécificité est comprise entre 73 et 100 %. Les MO lytiques apparaissent en hyposignal en T1 et en hypersignal en T2 ou en séquence STIR (figure 6). Les MO condensantes peuvent, en revanche, rester en hyposignal en T2 ou après injection de gadolinium. Figure 6. Métastases rachidiennes visibles en hyposignal (noir) sur les images IRM en séquence T1, en hypersignal (blanc) en séquence STIR et visualisation d’une compression médullaire associée, en séquence T1 avec injection de gadolinium. L’examen est très sensible aux mouvements du patient et la détection des MO est plus difficile au niveau des côtes. Il ne permet pas une étude précise de la structure osseuse comme la TDM qui reste nécessaire avant une thérapeutique ciblée. En revanche, l’IRM est indispensable en cas de suspicion de compression médullaire. Le développement des IRM corps entier devrait permettre, à l’instar de la scintigraphie osseuse, une analyse de l’ensemble du squelette. La TEP-FDG Le FDG-(18F) est un analogue radioactif du glucose qui s’accumule dans les cellules en fonction de la glycolyse, laquelle est augmentée dans les cellules cancéreuses. La visualisation des zones d’accumulation du traceur radioactif permet de repérer le tissu néoplasique (figure 7). Figure 7. Multiples foyers d’hyperfixation en TEP-FDG correspondant à de métastases osseuses et localisation précise des lésions par la fusion des images TEP et TDM. Sa sensibilité de détection des MO est très bonne, de 84 à 100 % selon les études et sa spécificité est supérieure à la scintigraphie osseuse, les lésions bénignes ne fixant pas ou peu le traceur. La détection des lésions peut être plus difficile pour des cancers avec une augmentation modérée de la glycolyse comme les carcinomes lobulaires invasifs ou les MO condensantes. L’ensemble du tronc est en général exploré lors de l’examen, mais une acquisition du corps entier est tout à fait possible. La fusion des images TEP avec les images TDM acquises en même temps, grâce aux caméras de dernière génération, permet une localisation précise de chaque anomalie d’hyperfixation. Le suivi des MO sous traitement Actuellement, il n’existe pas de critères d’évaluation permettant de mesurer la réponse au traitement des MO, quelle que soit la modalité d’imagerie utilisée. L’apparition de nouveaux foyers d’hyperfixation pathologiques sur les images de SO ou la disparition des anomalies sont en faveur d’une progression ou d’une régression des lésions. Cependant, les hyperfixations peuvent persister longtemps après un traitement efficace et l’interprétation peut être perturbée par le flare phenomenon, ou phénomène d’embrasement, qui induit une augmentation de l’intensité de fixation des anomalies, voire l’apparition de nouveaux foyers. Ces modifications sont secondaires à une augmentation de l’activité ostéoblastique au niveau des zones d’ostéolyse tumorales sous chimiothérapie ou hormonothérapie. Ce phénomène, consécutif à un processus de cicatrisation, concerne 10 à 15 % des patients. Sa présence n’est pas liée à un meilleur pronostic. Il apparaît dans les trois premiers mois du traitement et peut persister jusqu’à 6 mois et parfois plus. La disparition des MO en imagerie radiologique par rayons X est tardive et une augmentation de la densité d’une lésion condensante peut être consécutive à une progression comme à une cicatrisation de la lésion. L’IRM est en cours d’évaluation comme la TEP-FDG pour le suivi des MO sous traitement. La modification du signal, notamment pour les lésions lytiques, pourrait être en faveur d’une réponse tumorale. De même, la variation de l’intensité de fixation du FDG mesurée quantitativement par le SUV (Standard Uptake Value) serait fortement corrélée à la réponse au traitement (figure 8). Figure 8. Chez la même patiente, on visualise après 6 cures de chimiothérapie pour une récidive osseuse d’un cancer du sein : l’apparition d’un foyer d’hyperfixation dorsale en TEP-FDG (flèche jaune), la diminution d’un foyer d’hyperfixation sacré (SUV diminué de 40 %) (flèches bleues) et la disparition d’un foyer sacré (flèche verte) au niveau d’une zone antérieurement lytique. Sur les images TDM, ces 3 localisations osseuses s’accompagnent d’une ostéocondensation après traitement.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :