Publié le 20 sep 2010Lecture 9 min
Les choix des gonadotrophines en FIV et en ICSI : quel rationnel en 2010 ?
G. AGNANI, CHU-Hôpital Saint-Jacques, Besançon
Il est aujourd’hui clairement acquis que les chances d’obtenir une grossesse évolutive après stimulation ovarienne sont étroitement corrélées à l’âge de la patiente (1,2). Certains auteurs utilisent le terme d’horloge biologique pour évoquer cette diminution significative de la fertilité(2). L’assistance médicale à la procréation ne pouvant rattraper le temps perdu, le choix des stratégies thérapeutiques et des modalités de prise en charge du trouble de la fertilité est donc essentiel.
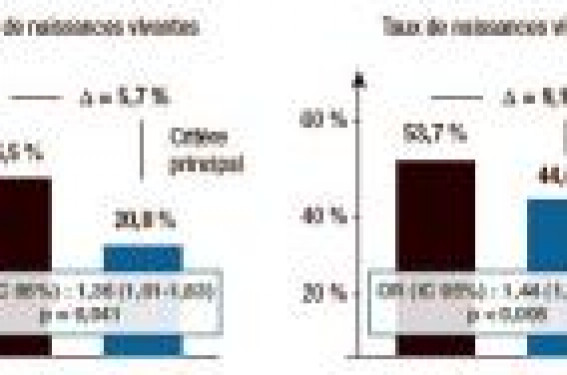
D’autres paramètres permettent d’estimer ce que l’on nomme aujourd’hui la réserve ovarienne : le taux basal de FSH (3), le nombre de petits follicules antraux observables en début de cycle en échographie (4) ou encore la concentration de l’hormone antimullérienne (5). Ces paramètres doivent être pris en considération quel que soit l’âge de la patiente. Ils permettent de détecter à la fois les mauvaises répondeuses et les hyper-répondeuses exposées au risque d’hyperstimulation. Ils permettent également de choisir les protocoles de stimulation et d’adapter les doses. Actuellement, la majorité des stimulations pour FIV et ICSI associent en Europe un agoniste ou un antagoniste de la GnRH et une gonadotrophine. Les principales gonadotrophines utilisées sont l’hMG-HP (Hautement Purifiée) et la FSH recombinante. On a longtemps reproché à la LH et aux hormones proches, comme l’hCG, de favoriser l’atrésie folliculaire ; mais que nous apporte l’analyse de la littérature récente ? Les résultats globaux en FIV/ICSI Nous disposons aujourd’hui de plusieurs métaanalyses comparant l’efficacité de l’hMG-HP et de la FSH recombinante. Les deux premières métaanalyses (6,7) avaient permis de constater leur égale efficacité. Les deux dernières (8,9) montrent une légère supériorité, statistiquement significative, de l’hMGHP sur le taux de naissances vivantes, critère principal d’évaluation de ces métaanalyses. Une nouvelle métaanalyse(10) a été présentée au congrès annuel de l’ESHRE qui s’est tenu à Amsterdam en 2009. Cette métaanalyse a analysé 11 études randomisées et contrôlées (soit 3 217 couples) et a comparé en FIV et ICSI les taux de naissances vivantes qui sont apparus significativement moins élevés sous FSH recombinante que sous hMG-HP (odds ratio = 0,84 [IC 95 % : 0,72-0,99])(10). Les taux de naissances étaient légèrement plus élevés sous FSH recombinante que sous FSH urinaire (OR = 1,29 [IC à 95 % : 1,00-1,67]). Aucune différence n’était observée lorsque l’on comparait la FSH urinaire purifiée à la FSH urinaire hautement purifiée(10). Un autre travail présenté au congrès de l’ESHRE confirme l’intérêt de l’hMG-HP. Ce travail avait pour objectif d’évaluer l’impact clinique (nombre des naissances vivantes) et économique des stimulations par hMG-HP et FSH recombinante (11). À partir des études EISG (12) et MERIT (13), les auteurs ont modélisé les taux de naissances vivantes obtenus après transfert d’embryons frais et décongelés (figure 1). Figure 1. Taux de naissances vivantes en FIV après 1 cycle de stimulation par hMG-HP ou rFSH. Les transferts d’embryons frais associés aux transferts des embryons décongelés ont permis d’obtenir un pourcentage de grossesses vivantes dans le bras hMG-HP de 53,7 % contre 44,6 % dans le bras FSH avec un OR = 1,44 [IC à 95 % 1,12-1,85 ; p < 0,005] (11). Les patientes incluses dans ces deux études étaient en général jeunes (âge moyen 31 ± 3,4 ans dans les 2 bras). Il s’agissait de premières tentatives dans la majorité des cas. La différence importante qui est observée ici entre l’hMG-HP et la FSH recombinante est liée à la prise en compte du transfert des embryons frais et des embryons congelés (figure 1). Cette différence a des conséquences économiques non négligeables, puisque ces auteurs britanniques estiment la réduction du coût pour obtenir une grossesse à 875 livres (11). Les situations particulières Mochtar (14) a confirmé, dans une métaanalyse, que l’apport de LH est bénéfique lorsque l’on traite des mauvaises répondeuses ou des patientes ayant présenté des avortements répétés. Ces étiologies sont plus fréquemment observées en FIV. Weghofer (15) conseille l’apport de LH chez les patientes mauvaises répondeuses quel que soit leur âge, et chez les patientes les plus âgées, de plus en plus nombreuses en FIV. L’ICSI Doses initiales On pourrait supposer que les difficultés de réponse ovarienne sont moins importantes lorsque l’on traite une infertilité d’origine masculine. La stimulation douce, qui assure une croissance folliculaire plus lente, permet de recueillir un nombre plus grand d’ovocytes ayant atteint le stade de métaphase II, qui est indispensable à la micro-injection. Partant de ces considérations, nous avons initialement traité les patientes en ICSI ayant un compte folliculaire > 8 par un protocole long avec 200 unités de FSH recombinante pendant les 3 premiers jours de stimulation. Le compte folliculaire correspondait à la somme de tous les petits follicules compris entre 2 et 8 mm. Il s’agissait de patientes de moins de 38 ans ayant une FSH normale. Les patientes ayant un compte folliculaire < 8 ou une FSH > 10 UI/l étaient traitées par un protocole court avec de l’hMG-HP. Nous avons constaté que les plus mauvais résultats étaient obtenus paradoxalement chez les patientes qui présentaient un compte folliculaire moyen, compris entre 8 et 13 (figure 2). Figure 2. Comparaison des résultats obtenus avant et après modification du traitement chez les patientes traitées par ICSI et ayant un compte folliculaire (CF) compris entre 8 et 13 (rFSH 200 UI/j (1re période) vs hMG-HP 225 UI/j (2e période)) après 3 jours de stimulation. Le traitement nʼa pas été modifié lorsque le compte folliculaire était < 8 ou ≥ 14. Le fait de traiter ces patientes par hMG-HP à la dose initiale journalière de 225 unités a permis d’améliorer significativement les résultats dans ce groupe moyen, alors que les résultats demeuraient inchangés dans les deux autres sous-groupes, le traitement initial n’ayant pas été modifié. Adaptation en cours de stimulation L’estimation de l’estradiolémie en cours de stimulation est habituellement utilisée pour prévoir les risques d’hyperstimulation. Mais Phelps (16) et De Placido (17) ont montré que l’estimation précoce de l’estradiolémie en protocole long avait également une valeur pronostique. De mauvais résultats sont observés lorsque l’estradiol est inférieur à 0,2 nmol/l à J + 4. L’hMG administrée précocement dans cette situation défavorable est susceptible de rétablir un bon pronostic. Considérant que l’estradiolémie devait être idéalement comprise entre 0,5 et 1 nmol à J + 4, nous avons étudié les résultats chez les patientes de moins de 38 ans traitées initialement, pour une 1re ou une 2e tentative, par protocole long avec 200 unités de FSH pendant les 3 premiers jours (tableaux 1 et 2). La FSH de base était < 10 unités et le compte folliculaire ≥ 14, cas le plus fréquent en ICSI. Des modifications de la prescription de gonadotrophines ont été apportées à J + 4 et à J + 6 si le taux d’estradiol ne doublait pas, alors qu’il était inférieur à 0,5 nmol à J + 4 (tableaux 1 et 2). Nous avons constaté que seul l’apport complémentaire précoce d’hMG-HP (+ 150 unités/jour à partir de J + 4) permet de conserver des résultats optimaux en cas de réponse insuffisante à J + 4. L’introduction tardive (J + 6) d’hMG-HP limite tout au plus le risque d’avortement spontané du 1er trimestre. Les moins bons résultats ont été observés en cas de recours à de fortes doses de FSH. Pour conclure formellement, il conviendrait de réaliser des études prospectives randomisées, mais cette fois ciblées sur des sous-populations parfaitement définies (par le compte folliculaire ou l’AMH, par la réponse initiale à la stimulation). L’enjeu nous paraît encore plus important en FIV classique où il existe des stérilités particulièrement difficiles à traiter (les stérilités inexpliquées de longue durée et certains types d’endométriose par exemple). Comment expliquer la supériorité de l’hMG-HP ? Ces résultats cliniques peuvent s’expliquer par plusieurs différences entre rFSH et hMG-HP, en particulier : Une progestéronémie moins élevée en fin de stimulation sous hMG-HP Tout d’abord, il a été montré que des taux de progestérone (P) anormaux en fin de stimulation (P > 4 nmol/l avant le déclenchement) sont plus fréquemment observés chez les patientes traitées par FSH, le déficit en LH limitant la conversion de la progestérone en androgènes (13). L’élévation prématurée de la progestérone est susceptible de perturber l’implantation puisqu’elle est associée à une augmentation de la fréquence d’une hyperéchogénicité de l’endomètre que l’on sait être un facteur de mauvais pronostic (13). Des embryons de meilleure qualité sous hMG-HP La qualité des embryons semble également dépendre du choix des gonadotrophines. Les taux d’embryons euploïdes sont ainsi plus élevés après stimulation par hMG-HP (18). Le nombre d’embryons de bonne qualité est également plus élevé avec l’hMG-HP et les embryons obtenus après stimulation par hMG-HP résistent mieux à la congélation dans leur ensemble (19). La présence de taux significatif d’hCG dans les préparations actuelles d’hMG-HP explique vraisemblablement la différence observée entre l’hMG-HP et la FSH recombinante (20) sachant que, par ailleurs, l’hCG a une demi-vie plus longue (24-33 h)(21) que la LH (10-12 h) (22). Conclusion Il est aujourd'hui établi que l’hMG donne au moins d’aussi bons résultats que la FSH, les dernières métaanalyses montrant même une supériorité significative en termes de naissances vivantes de l’hMG sur la rFSH en FIV avec ou sans ICSI. La supériorité de l’hMG s'affirme dans certaines situations observées en FIV classique telles que les anomalies de la réserve ovarienne. Mais, l’hMG semble également permettre d'obtenir de meilleurs résultats dans certaines situations où l’ICSI est utilisé, en particulier chez les patientes présentant un compte folliculaire moyen ou une concentration insuffisante d’estradiol plasmatique après 3 jours de stimulation.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :