Infertilité
Publié le 10 nov 2020Lecture 9 min
Aspects génétiques de l’infertilité masculine - Du chromosome à l’ADN
V. KOUBI, Laboratoire Eylau Unilabs Neuilly, Service de génétique
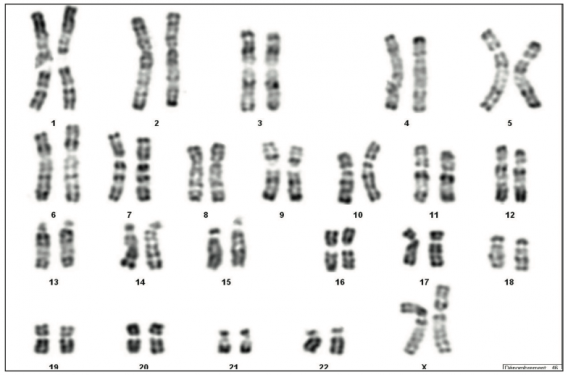
L’infertilité est un problème de santé publique, car environ 15 % des couples sont concernés en France. Environ 7 % de la population générale masculine est infertile. Lors du diagnostic d’infertilité́, l’origine masculine représente 50 % de celle-ci. L’origine générique masculine est prouvée dans 15 à 20 % des cas (Krausz, 2011 ; Krausz et coll., 2014), mais 40 % restent idiopathiques. Les étiologies peuvent être complexes et variées, car plus de 2 300 gènes sont impliqués dans la spermatogenèse (Gibson, 2010) d’où l’émergence de nouveaux tests génétiques, voire épigénétiques, et donc de nouveaux marqueurs d’infertilité́ masculine. Nous exposons les différentes anomalies les plus fréquentes en partant du chromosome, jusqu’à la molécule d’ADN puis présenterons différents cas cliniques pour illustrer ces pathologies.
Figure 1. Principales microdélétions du chromosome Y.
Principales anomalies chromosomiques responsables d’infertilité́ masculine
Les anomalies chromosomiques sont responsables de 6-7 % des infertilités masculines observées (Gekas et coll., 2001). Parmi les anomalies, on distingue celles de nombre et celles de structure.
Anomalies de nombre
Elles concernent les chromosomes sexuels ou gonosomes. L’anomalie la plus fréquente est le syndrome de Klinefelter (KS) à 47,XXY (fréquence : 1 homme/600) qui représente 36 % des anomalies génétiques masculines. Une azoospermie est présente dans > 92 % cas, mais elle n’est pas obligatoire en cas de mosaïcisme. Le syndrome de Klinefelter repose sur un diagnostic clinique et biologique ; ses risques principaux sont l’ostéoporose et surtout le cancer du sein. Par ailleurs, la présence d’une anomalie des gonosomes peut également engendrer un risque de non-disjonction méiotique au niveau des spermatozoïdes affectant les gonosomes (3 %) et les autosomes (1-2 %). Ainsi peut se poser la question d’un DPN ou d’une analyse de FISH sur sperme chez ses patients.
Les autres syndromes décrits sont la disomie Y ou syndrome du double Y : 47,XYY (fréquence : 1/1 000 ; 6 % des anomalies) et le XX male syndrome : 46,XX testicular DSD (fréquence : 1/20 000 ; azoospermie dans 100 % des cas).
Anomalies de structure
Les anomalies de structure des chromosomes représentent 13 % des infertilités masculines et sont associées à des anomalies sévères du spermogramme. Il peut s’agir :
– d’anomalies affectant les gonosomes comme les remaniements de structure de l’Y (6,7 % des anomalies) ou la translocation t (X ; Y) responsable de 80 % des XX male syndrome ;
– d’anomalies affectant les autosomes comme les translocations robertsoniennes retrouvées dans 14 % des azoospermies et 6,5 % des oligospermies (Nagvenkar et coll., 2005) ou les translocations réciproques, toutes deux responsables de déséquilibres au niveau des spermatozoïdes pouvant être à l’origine de fausses couches, échecs d’implantation, etc.
Principales anomalies géniques (moléculaires) responsables d’infertilité́ masculine
Elles représentent 15 à 20 % des infertilités masculines (Repping et coll., 2003 ; Vogt, 2005 ; Carvalho et coll., 2006 ; Viswambharan et coll., 2007). Les atteintes des gènes peuvent être de plusieurs sortes : délétion, duplication, CNVs, etc.
Microdélétions du chromosome Y
Elles sont responsables de 10 % des azoospermies non obstructives (ANO) et de 5 % des oligoasthénotératospermie (OATS). Il s’agit d’une perte d’un fragment du gène AZF situé sur les bras longs du chromosome Y et détectée par une PCR. Selon l’atteinte de la région AZF, les répercussions sur la spermatogenèse sont différentes : la délétion la plus fréquente est celle de la région AZFc incluant le gène DAZ responsable de 10 % des ANO, mais elle est de bon pronostic, car la spermatogenèse est conservée dans la grande majorité́ des cas. Les délétions d’AZFa et/ou AZFb sont responsables d’azoospermie.
Figure 2. Mutations du gène CFTR.
Figure 3. Mutations sur le gène AR.
Mutations du gène CFTR
Elles sont principalement responsables des syndromes d’absence des canaux déférents uni (CUAVD) ou bilatérale (CBAVD). Plus de 2 000 mutations sont décrites dans CFTR à l’heure actuelle. Dans les CBAVD, la mutation DF508 est la plus fréquente, associée à un variant polyT. Cependant, en cas de recherche négative, il faut pousser les explorations avec un séquençage complet du gène CFTR et ne pas oublier de tester la conjointe avant toute grossesse. Dans le CUAVD, 25 % sont associés à des mutations CFTR.
Variations du nombre de copies
Les techniques récentes de séquençage haut débit ont permis de détecter des variations du nombre de copies (CNV), différents polymorphismes, mais, pour beaucoup, il reste encore à déterminer leur pathogénicité́. À l’heure actuelle, deux gènes sont clairement impliqués dans l’inferilité masculine : les mutations du gène MTHFR (C677 et M1298) (Tutelmann et coll., 2007), et celles d’ESR1 et 2 (Hess, 2003).
Épigénétique
Elle consiste en l’étude de l’environnement du gène. L’expression d’un gène peut être modifiée par des phénomènes de méthylation ou de modifications des histones, qui modifient la structure de l’ADN sur lequel le gène est porté. Actuellement, il n’existe pas d’analyse en routine, mais plusieurs voies sont explorées dans le domaine de la recherche, en particulier l’influence de certains microARN miRNA (Carrell, 2012).
Mutations du gène Ar (Androgen Receptor)
Ces mutations constituent un cas particulier. Ce gène est localisé que les bras longs du chromosome X (Xq12). Il code pour la protéine AR qui est un facteur de transcription hormonodépendant. En cas de répétitions CAG > 39, il y a une corrélation avec infertilité́ et cryptorchidie (Tut et coll., 1997). Cependant, il existe des variations ethniques : Asiatiques, Caucasiens. De plus, la taille de la répétition du CAG est proportionnelle au degré́ d’azoospermie (Pan et coll., 2016). Ce gène est également impliqué dans le syndrome de Kennedy (amyotrophie spinale) et le syndrome d’insensibilité́ complète aux androgènes (CAIS).
Cas cliniques
Cas n° 1 (figure 4)
Figure 4. Caryotype sanguin en bandes G 47,XYY/cas clinique n°1.
Monsieur CB, 43 ans. Bilan pré-ICSI devant OAT.
Résultats : FSH, T, PRL = Normaux. OATS. Caryotype sanguin en bandes G : 47,XYY
Conclusion : présence d’un double Y isolé sans atteinte méiotique du sperme chez le paient (FISH sur sperme normale). Pas d’influence du 2e Y sur la spermatogenèse. Étiologie probablement non génétique de l’OAT.
Conduite à tenir : PMA possible avec sperme du conjoint (ICSI), car le bilan de la conjointe est sans anomalie. Pas de risque de transmission du double Y. Pas de diagnostic prénatal nécessaire.
Remarque : l’intérêt de la FISH sur sperme chez les hommes double Y est très faible, mais une étude de 2010 en PGD a démontré́ un risque accru d’anomalie des gonosomes chez les patients porteurs d’un double Y (Rodrigo et coll., Feril Steril 2010).
Cas n° 2 (figures 5 et 6)
Figure 5. Caryotype sanguin en bandes R 46,XX/cas clinique n°2.
Figure 6. FISH métaphasique avec la sonde DXZ1/SRY.
Monsieur TD, 28 ans. Bilan d’une azoospermie. Résultats : augmentation isolée de la FSH.
Caryotype sanguin : 46,XX.
Étude complémentaire : recherche de microdélétion du chromosome Y = aucune amplification obtenue ; réalisation d’une FISH métaphasique.
Conclusion : présence de 2 centromères de l’X, mais absence du locus SRY en Yp11.31.
L’absence de SRY est responsable de l’azoospermie. Or, le patient présente des caractères sexuels secondaires masculins, d’où la nécessité d’explorer d’autres gènes fonctionnels sur les autosomes (SOX3, SYCP3, USP9Y...) par séquençage complet (non réalisé en routine).
Conduite à tenir : conseil génétique indispensable. Le patient doit être orienté vers un don de sperme, et une enquête familiale doit être réalisée.
Cas n° 3 (figures 7 et 8)
Figure 7. Caryotype sanguin en bandes G 46,XY,t(8;14)(q ? 21.2 ; p13)/cas clinique n°3.
Figure 8. FISH métaphasique avec les sondes de peinture des chromosomes 8 et 14 et la sonde NOR.
Monsieur SB, 30 ans. Bilan d’une azoospermie. Résultats du bilan hormonal normaux, recherche de mutations de CFTR et de microdélétion de l’Y négatives. Écho-Doppler testiculaire : micro-lithiase bilatérale + hypotrophie testiculaire modérée + sténose épididymaire partielle droite. Caryotype sanguin : 46,XY,t(8;14) (q ? 21.2 ; p13).
Étude complémentaire : réalisation de techniques FISH métaphasiques complémentaires.
Conclusion : présence d’une translocation non réciproque entre un chromosome 8 et la région satellisée de l’un des chromosomes 14.
46,XY,t(8;14)(q21.2;p13).ish t(8;14)(q21.2;p13)(WCP8+ ; WCP14+,NOr+,WCP8+)
La translocation t(8;14) est à l’origine d’un arrêt de maturation de la spermatogenèse. Le patient présente également un antécédent de tuberculose pulmonaire pouvant être à l’origine des séquelles testiculaires observées sur l’écho-Doppler. L’origine de l’azoospermie chez ce patient est donc complexe : à la fois génétique et infectieuse.
Conduite à tenir : conseil génétique obligatoire. Orientation vers TESE/don de sperme. Prévoir une FISH sur sperme si possible. Pour une future grossesse, orientation vers un DPI de préférence, sinon prévoir un DPN avec recherche de DUP du 14.
Cas n° 4 (figure 9)
Figure 9. FISH interphasique avec la sonde centromérique DXZ1/DYZ3/cas clinique n°4.
Monsieur PT, 46 ans. Suspicion de syndrome de Klinefelter sur bilan endocrinologique perturbé. Le caryotype sanguin met en évidence une mosaïque :
mos 46,XX[2]/46,XY[2]/47,XXY[46].
Étude complémentaire : réalisation d’une technique FISH inter-phasique.
Conclusion : Confirmation d’une mosaïque de type KS like avec 3 lignées différentes.
mos 46,XX[2]/46,XY[2]/47,XXY[4 6].nuc ish(DXZ1x2)[1]/(DXZ1, DYZ3)x1[3]/(DXZ1x2,DYZ3x1)[96].
La présence d’une mosaïque forte est à l’origine du phénotype KS et devrait induire une azoospermie, mais il existe une lignée XY minoritaire. Il peut donc exister une spermatogenèse résiduelle. Cependant il persiste un risque d’anomalie de la ségrégation méiotique des gonosomes d’environ 1 % dans ce contexte.
Conduite à tenir : conseil génétique obligatoire. Discuter une chirurgie testiculaire si réalisable et un diagnostic prénatal ; pas de diagnostic préimplantatoire.
Cas n° 5 (figures 10 et 11)
Figure 10. Caryotype sanguin en bandes G 46,XY,rob(13;14)/cas clinique n°5.
Figure 11. Malségrégation d’une translocation rob(13;14).
Monsieur TM, 51 ans. Bilan pré-AMP avec un contexte d’OATS modérée.
Caryotype sanguin : 45,XY,rob (13;14)(q10;q10).
Conclusion : présence d’une translocation robertsonienne de façon homogène chez le patient.
Les translocations robertsoniennes sont très fréquentes (1/1 000). Leur impact sur la spermatogenèse est connu et induit en plus un risque d’aneuploïdie par effet interchromosomique (environ 2-3 % des cas).
Conduite à tenir : conseil génétique recommandé. Une FISH sur sperme peut être proposée au paient afin de vérifier la méiose spermatique et estimer le nombre de spermatozoïdes déséquilibrés. Le couple peut être orienté vers un diagnostic préimplantatoire ou par défaut un diagnostic prénatal avec une recherche de DUP du 14 de préférence.
Conclusion
L’infertilité́ masculine est une maladie multifactorielle complexe et un véritable problème de santé publique. L’identification précise du trouble de la spermatogenèse permet de mieux cibler les anomalies à rechercher.
La FISH sur sperme peut être un outil décisionnel selon les cas. Elle peut être « classique » ou « spécifique » d’une anomalie et donc adaptée à la pathologie suspectée.
Le séquençage complet du génome, ou génomique a mis à jour de nouveaux gènes, des polymorphismes nucléotidiques simples (SNP) et des variant pouvant être à l’origine des troubles de la spermatogenèse, mais qui restent à confirmer. Ces analyses font partie du domaine de la recherche ; elles sont longues et complexes dans l’interprétation des données. Il existe plus de 2 000 gènes intervenant dans la spermatogenèse : ATTENTION, un gène peut en cacher un autre !
L’analyse des facteurs épigénétiques ouvre de nouvelles pistes d’exploration, mais il s’agit là encore de recherche.
Enfin, il ne faut jamais oublier d’explorer la conjointe dans un bilan d’infertilité́, même en cas d’origine masculine avérée.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :