Publié le 10 oct 2017Lecture 20 min
Échec d’implantation d'embryon : que rechercher ?
Lucie DELAROCHE et coll., Laboratoire Eylau-UNILABS, Paris
Les causes d’échec d’implantation sont très variées, mais peuvent être regroupées en 2 grandes catégories soit cliniques soit embryonnaires. Il était précédemment admis qu’une réceptivité utérine inadéquate était responsable de deux tiers des échecs d’implantation et que l’embryon lui-même était responsable du tiers restant. Cependant, cette tendance est en train d’être renversée et la responsabilité de l’embryon dans ces échecs de plus en plus soulignée.
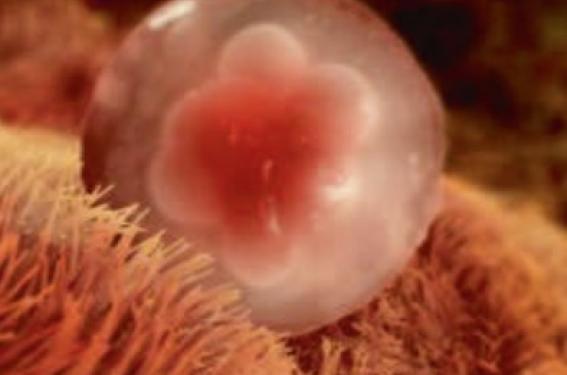
L’implantation est le processus au cours duquel l’embryon au stade de blastocyste éclos se fixe sur l’endomètre et s’y intègre au 7e jour de son développement. Elle se déroule en 3 étapes : apposition du blastocyste à la muqueuse utérine, adhésion, puis invasion du trophoblaste.
De façon classique, l’implantation est considérée comme le dialogue entre 2 partenaires, l’embryon et l’endomètre, mais de récentes études ont souligné le rôle des cellules du cumulus dans ce processus, notamment comme sources de prostaglandines et de facteurs angiogéniques (VEGF).
L’implantation a lieu pendant une période limitée entre le 20e et le 24e jour du cycle menstruel appelée fenêtre d’implantation, période caractérisée par un ensemble de modifications morphologiques et fonctionnelles de l’endomètre. Elle dépend d’une série de cascades de signalisation complexes qui sont sous l’influence d’un grand nombre de médiateurs moléculaires (molécules d’adhésion, facteurs de croissance, cytokines, lipides, etc.).
La relative inefficacité du processus d’implantation est paradoxale compte tenu du fait que la reproduction est essentielle pour la survie de l’espèce. En effet, en fertilité naturelle, seuls 20 à 25 % des couples fertiles parviendront à obtenir une grossesse lors d’un cycle menstruel lorsque les conditions de perméabilité tubaire, d’ovulation et de viabilité des spermatozoïdes sont réunies. Les taux de grossesses sont ensuite estimés à 74 %, 93 % puis 100 % après 6, 12 et 24 mois de rapports sexuels non protégés.
En assistance médicale à la procréation (AMP), le taux de grossesses cumulé est d’environ 40 à 55 % après 3 cycles de FIV et de 51 à 75 % après 6 cycles. Le nombre de couples en échec d’implantation est donc important. Lorsque plusieurs transferts d’embryons ne permettent pas d’obtenir une grossesse, on parle alors d’échec répété d’implantation (ou RIF = Repeated Implantation Failure). Il n’existe pas, à l’heure actuelle, de définition précise du RIF. La méta-analyse de Polanski souligne en effet l’hétérogénéité des définitions du RIF dans les 119 études publiées sur le sujet ; certaines se basant sur le nombre total de transferts, d’autres sur le nombre total d’embryons transférés, d’autres encore combinant ces 2 éléments ; d’autres enfin associant des paramètres de réserve ovarienne, de qualité embryonnaire et de jour de transfert. Certains auteurs parlent d’échec d’implantation si le test de grossesse est négatif ; d’autres en l’absence de sac gestationnel intra-utérin avec activité cardiaque. Tan va même jusqu’à exclure les transferts d’embryons congelés de la définition, du fait de leur moindre potentiel implantatoire. En 2011, le consortium ESHRE sur le PGD (Pre-implantation Genetic Diagnosis) a défini le RIF comme l’absence de sac gestationnel à l’échographie 5 semaines après au moins 3 transferts d’embryons de très bonne qualité ou après les transferts successifs d’au moins 10 embryons (ESHRE PGD Consortium, 2011). Depuis, Polanski a proposé la définition suivante : l’échec répété d’implantation s’entend par l’absence d’implantation définie par un taux d’hCG négatif 14 jours après la ponction suite à 2 cycles de FIV ou ICSI avec transferts d’embryons frais ou congelés où le nombre total d’embryons transférés est ≥ 4 embryons précoces ou 2 blastocystes présentant une cinétique de développement embryonnaire appropriée et une morphologie satisfaisante.
Figure 1. Succès de l'implantation = dialogue synchronisé entre l'embryon et l'endomètre.
Figure 2. Chronologie du processus d'implantation qui se déroule en 3 phases :
apposition du blastocyste éclos, adhésion à la muqueuse utérine, puis invasion.
Figure 3. Définition de la fenêtre d'implantation = période de réceptivité de l'utérus
entre le 21e et le 24e jour du cycle menstruel lors de laquelle l'embryon peut s'implanter.
Facteurs cliniques pouvant influencer l’implantation
La cavité utérine
Devant un échec d’implantation, une des premières explorations à mener inclut l’examen de la cavité utérine. Il semble en effet que la fréquence des pathologies utérines non diagnostiquées dans les échecs répétés d’implantation s’élève entre 25 et 50 %. Il peut s’agir soit de malformations congénitales (utérus cloisonné ou bicorne), soit de malformations acquises (fibromes utérins sous-muqueux interstitiels, polypes endométriaux, synéchies) ; toutes peuvent interférer de différentes façons avec les mécanismes régissant l’implantation.
• La cloison utérine
La cloison utérine représente l’une des anomalies utérines les plus fréquemment retrouvées. Elle a longtemps été associée à une augmentation du risque de fausse couche du 1er trimestre à cause d’un défaut de vascularisation du septum, mais elle est également responsable d’échecs répétés d’implantation, comme l’a montré Lavergne en observant une diminution des taux de succès chez des femmes dont la cloison n’a pas été réséquée, comparativement aux femmes dont la cloison a été réséquée. Pourtant, l’indication chirurgicale devant le diagnostic d’une cloison utérine chez une nulligeste n’est pas encore tranchée.
• Les fibromes
La présence de fibromes sousmuqueux et intracavitaires peut perturber l’implantation, car ils entraînent une augmentation de la contractilité utérine, des perturbations des profils d’expression cytokinique, des défauts de vascularisation et une chronicité inflammatoire endométriale. Dans sa métaanalyse, Pritts a conclu que les taux de grossesses et d’implantations étaient significativement diminués en cas de fibromes, et que leur résection permettait d’améliorer les taux de succès. Shokeir a confirmé ces résultats en montrant que la résection hystéroscopique des fibromes permettait de doubler les taux de grossesses cliniques en cas d’infertilité primaire inexpliquée. Pour ce qui est des fibromes interstitiels, il existe des conclusions controversées, certaines études montrant leur influence négative sur l’implantation à partir de 4 cm ; d’autres ne la retrouvent pas. Trois méta analyses arrivent au consensus qu’il existe bien une diminution significative des taux d’implantations en cas de fibromes interstitiels de plus de 35 mm.
Leur traitement par myomectomie ne semble néanmoins pas améliorer les taux de naissances vivantes, probablement du fait de la fragilisation du myomètre lors du processus de cicatrisation et de l’apparition d’adhérences postopératoires en cas d’ouverture de la cavité.
• Les polypes
Les polypes endométriaux peuvent également être à l’origine d’échecs d’implantation : leur résection semble bénéfique puisqu’une augmentation du nombre de grossesses spontanées a été observée par plusieurs auteurs.
• Les synéchies
Les synéchies ou adhérences intracavitaires, qui surviennent après un curetage notamment, peuvent perturber l’attachement de l’embryon à la surface luminale de l’endomètre et ainsi diminuer l’implantation. Elles sont en effet retrouvées dans 8,5 % des échecs d’implantation (Demirol and Gurgan, 2004). Leur résection hystéroscopique semble restaurer en partie la fertilité.
• L’utérus distilbène
Le DES commercialisé en France de 1950 à 1974 et utilisé dans la prévention des FCS a été à l’origine de nombreuses anomalies utérines chez les femmes exposées in utero (béance cervico-isthmique, hypoplasie, anomalies des cornes, utérus en T, etc.). Des données limitées sur les taux de succès après FIV chez les patientes présentant des anomalies utérines congénitales comme l’utérus DES, suggèrent une diminution des taux d’implantations et de grossesses. La question de la plastie utérine est débattue en cas de cavité pré- sentant un anneau de striction médio-cavitaire du fait des risques opératoires et de synéchies.
• L’hypoplasie utérine
L’étude doppler des artères utérines n’a pas permis de montrer un facteur prédictif dans l’implantation. Une vascularisation suffisante de l’utérus est nécessaire pour obtenir une réceptivité endométriale optimale. Le doppler des artères utérines permet de donner un index de pulsatilité (IP) qui est le reflet de la vascularité utérine. Différents seuils ont été donnés au-delà desquels les chances d’implantation sont faibles. Classiquement, un IP > 3 est considéré comme péjoratif pour l’implantation.
Avec l’avènement de l’échographie 3D, l’analyse de la vascularisation 3D endométriale et sous-endométriale a été largement étudiée ; toutefois, les résultats contradictoires des différentes études ne permettent pas de trancher actuellement. Il n’est par ailleurs pas possible de réaliser de métaanalyse du fait des différences de réglages des machines et de la définition de la zone sous-endométriale pouvant varier selon les études de 1 à 5 mm et donc induire de larges variations des résultats.
L’endomètre
• L’endométriose
Le lien entre endométriose et échec répété d’implantation n’a pas été directement établi, mais selon le stade de l’endométriose et sa localisation, des séquelles inflammatoires et des adhérences peuvent perturber la fertilité : très souvent, l’ensemble des marqueurs des processus reproductifs (réponse ovarienne, qualité embryonnaire, implantation, etc.) sont diminués.
L’endométriose est associée à des modifications anatomiques de la cavité pelvienne (variables, dépendantes de la localisation de l’endométriose et de son stade), à des modifications cytologiques et biochimiques du liquide péritonéal et à des altérations du liquide folliculaire (augmentation de la sécrétion des cytokines et du TNF-α [Tumor Necrosis Factor-alpha] par les cellules de la granulosa altérant la qualité ovocytaire), l’ensemble de ces modifications diminuant donc l’implantation.
L’endométriose perturbe le système immunitaire de l’endomètre : il a été rapporté une augmentation des immuno globulines G et A et des lymphocytes dans l’endomètre, une augmentation des cytokines IL-1β, IL-6, IL-11 et du TNF-α et une diminution de la production des métalloprotéases. L’endomètre des patientes endométriosiques serait capable de synthétiser l’aromatase, enzyme permettant de produire de l’estradiol. Or, l’augmentation du taux d’estradiol au sein de l’endomètre est néfaste à l’implantation.
• L’adénomyose
La prévalence de l’adénomyose dans les échecs d’implantation n’est pas clairement définie. Maheswari et Sunkara ne retrouvent pas d’effet de l’adénomyose sur les taux de grossesses ou de FCS. Elle n’est donc généralement pas considérée comme une cause d’infertilité, sauf pour les formes cryptiques. Cependant, des études récentes ont rapporté, chez les patientes souffrant d’adénomyose, des taux d’implantation diminués et des taux de FCS augmentés, suggérant que l’adénomyose puisse bien interférer avec l’implantation. Tremellen a retrouvé dans les biopsies d’endomètre de 64 patientes, en échec d’implantation et souffrant d’adénomyose, une augmentation significative du taux de macrophages et de cellules tueuses naturelles dans le stroma de l’endomètre. Ces résultats soulignent d’éventuels mécanismes immunologiques par lesquels l’adénomyose peut interférer avec l’implantation de l’embryon.
• L’épaisseur endométriale
La présence d’un endomètre fin, spontanée ou suite à un curetage ou à des cures de synéchies utérines ou d’endométrites chroniques, serait-elle un critère d’échec d’implantation? Les conclusions de la littérature sont discordantes sur ce sujet : certains auteurs n’ont pas retrouvé d’impact péjoratif. D’autres au contraire ont constaté une diminution des taux d’implantation et de grossesse pour une épaisseur endométriale inférieure à 6 mm, à 8 mm, à 9 et 10 mm.
Une récente métaanalyse sur 22 études a confirmé que l’épaisseur de l’endomètre n’était pas prédictive de la survenue d’une grossesse, même si cette étude a cependant retrouvé, dans un sous-groupe de 11 études, une diminution des taux de grossesses quand l’épaisseur endométriale était inférieure à 7 mm (OR à 0,38).
• L’expression moléculaire endométriale
Certains cas d’échec d’implantation peuvent être attribués à des dérégulations locales de l’expression de cytokines. En effet, un excès de cellules NK endométriales, des taux anormalement élevés d’interleukines (IL-12, 15, 18, IL-1β) ou anormalement bas (IL-10 et interféron-γ) ont pu être observés chez les patientes en échec. Aussi, l’absence d’apparition de l’intégrine αVβ3 sur l’endomètre ou deschangements d’expression des pinopodes lors de la fenêtre d’implantation peuvent-ils conduire à des échecs.
• La fenêtre d’implantation
L’endomètre n’est réceptif qu’à une période donnée du cycle menstruel, à savoir pendant la fenêtre d’implantation. Tout décalage de cette fenêtre risque de conduire à un échec d’implantation qui doit, dans ce cas, être renommé échec de timingd’implantation. L’identification parfaite de cette fenêtre est donc essentielle.
La fenêtre d’implantation a été longtemps évaluée par les critères histologiques de Noyes. Plus récemment, des évaluations transcriptomiques ou protéomiques ont été proposées, en particulier vial’étude des profils d’expression génique en phase préréceptive et réceptive du cycle menstruel. Deux études ont mis en évidence des dérégulations transcriptomiques dans les biopsies d’endomètre effectuées à Pg + 7 (n = 63 transcrits) ou à J21 (n = 313 gènes) chez des patientes en échec d’implantation par rapport aux patientes contrôles. L’équipe de DiazGimeno a montré via son test ERA (Endometrial Receptivity Array)basé sur l’expression de 238 gènes différemment régulés en phases préréceptive et réceptive que 25,9 % des patientes en échec d’implantation avaient un endomètre non réceptif dû à un décalage de la fenêtre d’implantation. De même, l’équipe d’Hamamah a développé le WIN test qui offre la possibilité de connaître, en cycle naturel ou THS, le statut réceptif (avec fortes chances d’implantation) ou non réceptif de l’endomètre grâce à l’analyse de l’expression de 13 gènes liés à l’implantation.
• Les effets de la stimulation sur l’endomètre
Il est désormais admis que la stimulation ovarienne et les fortes doses de FSH administrées ont des effets néfastes sur l’endomètre : les taux supraphysiologiques d’estradiol et de progestérone sont responsables de modifications morphologiques et biochimiques, d’altérations de l’expression de nombreux gènes liés à l’implantation et de dérégulations de l’expression de miRNA et mRNA. De tels changements affectent la synchronisation entre l’embryon et l’endomètre, diminuant alors l’implantation. Cette hyperestradiolémie risque d’augmenter la contractilité utérine, diminuant là encore les chances d’implantation.
Les annexes
Les hydrosalpinx ont en effet des conséquences néfastes sur l’implantation, en raison de leur embryotoxicité et des mécanismes de flushing embryonnaire extra-utérin engendrés par le liquide tubaire accumulé. D’un point de vue moléculaire, il semble que l’expression du LIF (Leukemia Inhibitory Factor), cytokine nécessaire à l’implantation, soit anormalement diminuée en cas d’hydrosalpinx, son expression pouvant être restaurée en cas de salpingectomie ou de ligature proximale. Ainsi, les patientes présentant des hydrosalpinx ont bien des taux de grossesse et d’implantation diminués et la salpingectomie reste le traitement de référence.
L’auto-immunité et la thrombophilie
De nombreux cliniciens restent attachés à l’hypothèse que la thrombophilie puisse être une cause d’échec d’implantation, même si ce lien n’est pas clairement établi. Le travail de Martinelli sur une large série de 468 patientes n’a pas retrouvé d’association entre thrombophilie et échec d’implantation. De même, les travaux de Simur ont conclu que les mutations du facteur V Leiden, de la MTHFR et de la prothrombine n’avaient pas de lien avec l’échec d’implantation. Le comité de la Société américaine de reproduction a conclu en 2008 que la présence d’anticorps antiphospholipides n’affectait pas les résultats de la FIV (Practice Committee of ASRM, 2008). Depuis, la métaanalyse de Di Nisio portant sur 29 études de cas a montré que la présence des anticorps antiphospholipides était associée à une augmentation par 3 du risque d’échec d’implantation.
Chighizola et coll. 2014, et la Task Force antiphospholipid Auto immunR 2014rapportent qu’il y aurait plusieurs sous-groupes d’antiphospholipides, dont seule une minorité serait responsable des FCS à répétions ou d’échecs d’implantation. Cependant, comme les techniques diagnostiques actuelles ne peuvent distinguer ces différents sousgroupes, il y a actuellement surtraitement des patientes, par anticoagulant et aspirine, probablement inutile et donc potentiellement néfaste.
La fonction thyroïdienne
Il semble qu’une dysfonction thyroïdienne puisse perturber l’implantation : Toulis a retrouvé un risque de FCS deux fois plus important chez les patientes présentant une thyroïdite autoimmune (TAI) (présence d’anticorps antiperoxydase ou antithyroglobuline). Il est donc primordial de contrôler cette fonction devant un échec d’implantation.
L’hygiène de vie
Tout bilan d’échec d’implantation doit prendre en compte l’hygiène de vie des patients, particulièrement les facteurs d’obésité et le tabac. L’impact négatif de l’obésité maternelle sur les taux de succès en FIV est largement admis, mais l’obésité n’est pas en elle-même une cause d’échec d’implantation.
Le tabac est, lui aussi, un facteur péjoratif d’implantation : la métaanalyse de Waylen a retrouvé une baisse des taux de naissances vivantes et une augmentation des FCS en cas de tabagisme maternel actif. Les effets néfastes de la cigarette se ressentent également chez les fumeuses passives puisque Benedicte a rapporté un risque d’échec d’implantation, augmenté de 52 % chez les femmes exposées au tabac versus celles non exposées.
Facteurs biologiques – gamètes et embryons – pouvant influencer l’implantation
Le second élément indispensable au succès de l’implantation est l’embryon.
Le contenu génétique
• Les anomalies chromosomiques gamétiques et embryonnaires
Les anomalies chromosomiques observées dans l’embryon préimplantatoire peuvent être des anomalies de nombre ou de structure. L’embryon est aneuploïde en cas d’addition (trisomie) ou de délétion (monosomie) d’un chromosome, ou mosaïque s’il est constitué de plusieurs lignées cellulaires de contenus chromosomiques différents. Il est rapporté que l’aneuploïdie concerne près de 53,8 % des blastocystes des patientes en échec d’implantation.
Harper a été le premier à montrer en 1995 par FISH (Fluorescent in situ hybridization) que les aneuploïdies de l’embryon précoce étaient dues soit à des erreurs méiotiques soit à des erreurs postzygotiques.
La survenue d’erreurs méiotiques, principalement d’origine maternelle, augmente avec l’âge et entraîne un surrisque d’échec d’implantation ou de FCS. Ces erreurs sont dues à une nondisjonction méiotique (MND), ou plus fréquemment à une séparation prématurée des chromatides sœurs (PSSC).
La contribution paternelle aux aneuploïdies embryonnaires n’est cependant pas nulle : des anomalies du centrosome transmises par le spermatozoïde peuvent être à l’origine des mosaïques chaotiques embryonnaires observées en FIV. Également, la survenue d’altérations lors des étapes de remodelage de la chromatine spermatique augmente la fréquence des aneuploïdies observées dans les embryons fécondés à partir de spermes OAT sévères.
Des anomalies postzygotiques peuvent survenir de façon aléatoire au cours des mitoses (principalement les 3 premières) et donner lieu à des embryons chaotiques dont le développement se bloque le plus souvent en période pré- ou postimplantatoire.
Au-delà des contributions méiotique et mitotique, certains facteurs cliniques peuvent influencer la survenue d’aneuploïdies embryonnaires : les pathologies comme le syndrome des ovaires polykystiques (SOPK), l’endométriose ou l’insuffisance ovarienne souvent associées à une qualité ovocytaire moindre ; la stimulation ovarienne et la maturation in vitro (MIV) peuvent augmenter les taux d’aneuploïdies.
Face à la survenue des aneuploïdies embryonnaires, des mécanismes de réparation sont mis en place, notamment l’activation de p53 qui permet l’apoptose des blastomères anormaux. Cette autocorrection est observée aux stades tardifs du développement préimplantatoire. En effet, Munne a étudié le développement de 145 embryons aneuploïdes à J3 (FISH) et a montré que, parmi les 55 d’entre eux ayant évolué jusqu’au stade blastocyste, 18 se sont « normalisés ».
Ces résultats ont été corroborés par l’étude de Li qui rapporte que 40 % des embryons aneuploïdes à J3 (FISH) deviennent euploïdes à J5. Aussi, plus récemment, par la technique des SNP basée sur l’analyse de 24 chromosomes, Northrop a observé que 65 % des embryons monosomiques, 47 % des embryons trisomiques et 63 % des embryons aneuploïdes complexes à J3 devenaient euploïdes à J5.
La responsabilité des aneuploïdies embryonnaires dans les échecs répétés d’implantation a été très rapidement évoquée.
Voullaire a montré par CGH array (Comparative Genomic Hybridization) que plus de 60 % des blastomères issus d’embryons de couples en échec d’implantation étaient aneuploïdes malgré une morphologie embryonnaire satisfaisante. De même, Pehlivan a retrouvé un taux d’anomalies chromosomiques significativement plus élevé pour les chromosomes 13, 16, 18, 21, 22, X et Y dans les embryons de J3 biopsiés de femmes en échec d’implantation versus contrôles (67,4 % vs 36,3 %).
• Les explorations chromosomiques
La fréquence élevée des aneuploïdies de l’embryon préimplantatoire, notamment en cas d’échec d’implantation, amène à contrôler les caryotypes des deux membres du couple, même si un caryotype normal n’exclut pas la production de gamètes aneuploïdes. L’équipe de Stern a été la première à montrer une augmentation de l’incidence des anomalies des caryotypes (2,5 %) dans le groupe des couples en échec d’implantation (n = 514). Ces anomalies chromosomiques touchaient aussi bien l’homme que la femme et la moitié d’entre elles (1,4 %) étaient des translocations. Cette étude a été corroborée par les travaux de Raziel qui ont montré, chez 65 femmes en échec d’implantation, un pourcentage étonnamment très élevé de caryotypes anormaux (15,4 %). Depuis ces études, l’analyse des caryotypes des 2 membres du couple en cas d’échec d’implantation est devenue une pratique courante. La FISH sur sperme peut également apporter des éléments de réponse car l’incidence des d’échecs d’implantation ou des FCS à répétition se révèle être plus élevée en cas d’anomalies chromosomiques spermatiques. Sanchez-Castro a montré que les aneuploïdies spermatiques avaient une influence directe sur les anomalies chromosomiques embryonnaires, notamment en cas d’OAT ou de sévères perturbations spermatiques. Aussi, Burello a rapporté des taux d’implantations significativement plus bas (13 % vs34 %, p < 0,001) dans le groupe de patients avec un taux d’aneuploïdies (FISH) dans le sperme élevé (3,25 %) vs faible (1,25 %).
Devant un échec d’implantation, faut-il systématiquement rechercher la présence d’aneuploïdies embryonnaires par le screening génétique préimplantatoire (PGS) ? Il a été montré que la morphologie embryonnaire n’est pas corrélée au taux d’aneuploïdies.
Le PGS n’est actuellement pas autorisé en France, mais il est largement pratiqué dans les pays anglo-saxons. Il consiste en l’étude du contenu chromosomique d’un ou plusieurs blastomères afin de distinguer les embryons aneuploïdes des embryons euploïdes alors sélectionnés pour le transfert. Les premiers PGS ont été réalisés par FISH sur embryon précoce avec analyse d’un nombre restreint de chromosomes. Depuis, les techniques ont évolué vers l’analyse du blastocyste, en particulier des cellules du trophectoderme, par CCS (Comprehesive Chromosome Screening) permettant l’analyse complète des chromosomes soit par mCGH (metaphase comparative genomic hybridization), aCGH (array comparative genomic hybridization), SNP (single nucleotide polymorphism micro array), qPCR (quantitative polymerase chain reaction) ou plus récemment par NGS (next generation sequencing).
Les indications actuelles du PGS sont l’âge maternel avancé (AMA), les FCS à répétition, l’infertilité masculine sévère, ainsi que les échecs répétés d’implantation. La métaanalyse de Dahdouh n’a cependant pas retrouvé d’intérêt à pratiquer un PGS en cas d’échec d’implantation puisque les taux de naissances vivantes étaient significativement diminués dans le groupe des couples en échec d’implantation comparativement au groupe contrôle, probablement en raison des effets délétères de la biopsie et de l’absence de screening complet des chromosomes pour la plupart des études prises en compte (FISH uniquement).
A contrario, Greco a montré par CGH array l’intérêt du PGS chez les couples en échec d’implantation puisqu’il a rapporté des taux de grossesses et d’implantation respectivement de 68,3 % et 68,3 % après transfert d’un blastocyste euploïde dans le groupe RIF-PGS vs 22,0 % et 21,2 % dans le groupe RIF-NO PGS.
Pagidas a montré qu’après un échec d’implantation malgré le transfert d’un blastocyste euploïde lors d’un premier cycle de PGS, la présence d’embryons euploïdes au second ou troisième cycles de PGS est toujours associée à des taux de grossesses et d’implantation élevés.
• Les explorations spermatiques
La contribution paternelle au potentiel implantatoire de l’embryon doit faire l’objet d’explorations en cas d’échecs d’implantation. De nombreux auteurs ont suggéré qu’une baisse de la qualité du sperme pouvait diminuer les chances de succès des techniques d’AMP en particulier, via une compaction anormale de la chromatine ou encore une fragmentation élevée de l’ADN spermatique. Une importante fragmentation de l’ADN spermatique peut affecter le développement de l’embryon après activation du génome paternel, à savoir dès J3, et conduire à un échec d’implantation. Il a été rapporté que 28 % des hommes infertiles présentent un taux de fragmentation élevé contre 13 % pour les hommes fertiles (Practice Committee of ASRM, 2008). Avendano a montré qu’un spermatozoïde de morphologie normale pouvait néanmoins avoir un taux de fragmentation élevé. Son étude a aussi montré que le taux de fragmentation était plus élevé chez les partenaires de femmes en échec d’implantation comparativement à ceux de femmes qui ont réussi à concevoir (33,8 % vs 18,9 %).
La zone pellucide
L’éclosion du blastocyste, c’est-à-dire sa sortie au travers de la zone pellucide (ZP), est un prérequis indispensable à l’implantation. Elle implique une combinaison de réactions mécaniques et biochimiques entraînant l’amincissement de la ZP jusqu’à sa rupture. Un échec d’éclosion (dû à des défauts intrinsèques au blastocyste ou à la ZP) pourrait de facto expliquer un échec d’implantation.
Les conditions de culture de l’embryon
Une hypothèse avance que l’échec d’implantation pourrait être en partie dû aux milieux de culture qui ne seraient pas suffisamment optimaux pour garantir un bon potentiel implantatoire des embryons dans lesquels ils sont cultivés. Plusieurs équipes ont en effet rapporté de meilleurs résultats chez les couples en échec d’implantation lorsqu’une co-culture était pratiquée comparativement aux milieux standards ; en revanche, cela n’est pas démontré dans une population de patientes non sélectionnée.
Conclusion
Une hypothèse avance que l’échec d’implantation pourrait être en partie dû aux milieux de culture qui ne seraient pas suffisamment optimaux pour garantir un bon potentiel implantatoire des embryons dans lesquels ils sont cultivés. Plusieurs équipes ont en effet rapporté de meilleurs résultats chez les couples en échec d’implantation lorsqu’une co-culture était pratiquée comparativement aux milieux standard ; en revanche, cela n’est pas démontré dans une population de patientes non sélectionnée. Conclusion Le succès de l’implantation dépend d’une parfaite synchronie entre deux principaux partenaires, la patiente en tant qu’hôte et l’embryon. Toute perturbation de l’environnement de l’hôte (pathologies utérines, endomètre non réceptif, thrombophilie, etc.) peut affecter négativement ce dialogue embryon-endomètre. De même, toute anomalie de l’embryon (génétique, etc.), qu’elle soit d’origine ovocytaire ou spermatique, peut diminuer le potentiel implantatoire de l’embryon et conduire à l’échec d’implantation, classiquement défini comme l’absence de grossesse après au moins 3 transferts d’embryons de très bonne qualité ou après transferts d’au moins 10 embryons (ESHRE PGD Consortium, 2011).
Les investigations à mener en cas d’échec d’implantation sont donc vastes. Le bilan d’implantation doit inclure un ensemble d’explorations fonctionnelles (ultrasonographie, hystéro-salpingographie, sonohystéroscopie, hystéroscopie, etc.), un bilan immuno-hématologique complet, l’analyse des caryotypes des deux membres du couple ainsi que l’étude de la fragmentation et de la décondensation de l’ADN spermatique. Le bilan pourra être complété par l’évaluation de la réceptivité endométriale par une approche soit immunotrophique viale Matricelab, soit transcriptomique via les WIN et ERA tests. Ainsi, devant un échec d’implantation, le challenge est donc d’identifier l’ensemble des causes traitables afin de les corriger et de discerner les vrais échecs d’implantation des insuffisances gamétiques non diagnostiquées jusque-là.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :