Publié le 27 jan 2010Lecture 8 min
Les hormones thyroïdiennes au cours de la grossesse
F. BORSON-CHAZOT - Fédération d’endocrinologie, Groupement hospitalier Est, Bron
La grossesse modifie profondément le fonctionnement thyroïdien maternel et accroît les besoins en hormones thyroïdiennes. La nécessité de majorer le traitement substitutif d’une femme hypothyroïdienne et de dépister une femme à risque de développer une hypothyroïdie au cours de la grossesse doit être connue car les risques sont importants pour la mère et l’enfant.
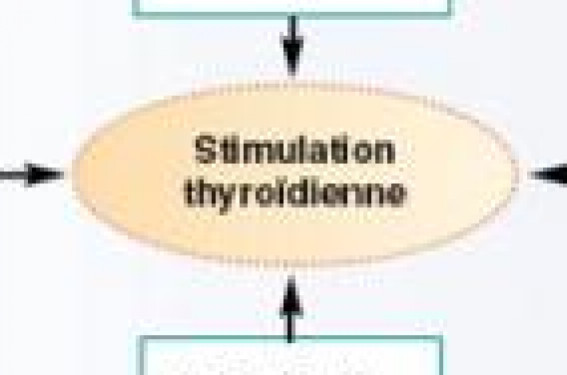
Modifications de la physiologie thyroïdienne La grossesse est à l’origine de contraintes thyroïdiennes importantes passant par plusieurs mécanismes (figure 1). ● Sous l’effet des estrogènes, la concentration plasmatique des protéines de transport des hormones thyroïdiennes et notamment de la T4-binding globulin (TBG) augmente de la 6e à la 20e semaine puis reste stable jusqu’au terme de la grossesse (2,5 fois le taux initial). Cela entraîne une majoration de l’activité fonctionnelle de la thyroïde pour maintenir stable la fraction libre active qui représente, dans les conditions basales, 0,04 % de la T4 et 0,5 % de la T3. ● L’hCG produite par le placenta, possède une importante homologie structurale avec la TSH, ce qui lui confère un rôle d’agoniste du récepteur de la TSH et conduit à une stimulation de la production hormonale thyroïdienne pendant le 1er trimestre de gestation. ● La désiodase de type 3 (D3) produite par le placenta est une enzyme inactivatrice qui catalyse la transformation de T4 en rT3 et de T3 en diiodothyronine (T2), toutes deux inactives. Elle pourrait constituer un mécanisme de protection du foetus contre un risque d’exposition excessive aux hormones thyroïdiennes maternelles, mais son activité n’est que faiblement réduite en cas d’hypothyroïdie. Figure 1. Contraintes thyroïdiennes au cours de la grossesse ● Les besoins en iode augmentent en raison de l’augmentation de la clairance urinaire de l’iodure et du fait qu’une fraction de l’iode circulant passe la barrière foeto-placentaire afin de couvrir les besoins fœtaux Ces modifications conduisent à une majoration des besoins en hormones thyroïdiennes, estimée entre 30 et 50 %, et peuvent être à l’origine d’une décompensation d’une hypothyroïdie méconnue jusqu’alors. Les hormones thyroïdiennes indispensables au déroulement normal de la grossesse On estime que 0,3 à 0,7 % des femmes enceintes présentent une hypothyroïdie avérée définie par une élévation de TSH s’accompagnant d’un abaissement de la T4 libre. Celle de l’hypothyroïdie infraclinique se traduisant par une élévation isolée de TSH est plus importante, de l’ordre de 2,2 à 2,5 %. Dans plus des deux tiers des cas, l’insuffisance thyroïdienne est secondaire à une thyroïdite auto-immunitaire. L’hypothyroïdie est classiquement associée à une diminution de la fertilité et à une augmentation des risques de fausse-couche précoce. La grossesse chez la femme hypothyroïdienne s’accompagne également d’une augmentation du risque de complications obstétricales, qu’il s’agisse d’hypertension gravidique, de prééclampsie et d’hémorragies du post-partum. La mortalité foetale est également majorée et le risque de fausses couches spontanées et de morts foetales in utero est directement corrélé à la valeur de TSH avec un doublement du risque pour tout doublement de la valeur de la TSH. Les hormones thyroïdiennes de la mère indispensables au développement normal du foetus La thyroïde foetale acquiert progressivement ses capacités de production d’hormones thyroïdiennes. À 4 semaines de gestation, elle est capable de synthétiser la thyroglobuline ; 6 à 8 semaines plus tard, elle acquiert sa capacité à capter l’iode puis, progressivement, à synthétiser les hormones thyroïdiennes (HT). La thyroïde du foetus n’est pleinement fonctionnelle qu’après le 1er trimestre de gestation, alors que les hormones thyroïdiennes sont essentielles au développement embryonnaire puis foetal dès la conception. En début de grossesse, les HT nécessaires au développement foetal proviennent donc de la mère. Elles peuvent traverser le placenta et moduler le développement du foetus avant que sa thyroïde ne soit active, mais la contribution maternelle au maintien d’un taux suffisant d’hormones thyroïdiennes dans la circulation foetale se poursuit jusqu’à la naissance. Figure 2. Stratégie proposée par l’HAS pour le dépistage et la prise en charge des hyperthyroïdies frustes de la femme enceinte (avril 2007). Ce passage transplacentaire des HT a été longtemps ignoré. La mise en évidence de concentrations plasmatiques significatives de triiodothyronine libre (T3L) et de tétraiodothyronine libre (T4L) chez des nouveau-nés atteints d’hypothyroïdie congénitale sans aucune production hormonale endogène a confirmé l’hypothèse d’un transport transplacentaire des hormones thyroïdiennes d’origine maternelle. La T4L d’origine maternelle gagne le compartiment coelomique après transfert transplacentaire, puis le sac vitellin et enfin la circulation foetale. Les hormones thyroïdiennes sont indispensables au développement cérébral. Des modifications mêmes minimes du statut thyroïdien maternel en début de grossesse ont été associées à des troubles neurologiques et des retards psychomoteurs de l’enfant. Il a été montré que le score de QI est directement corrélé au taux de T4L au 1er trimestre et en milieu de grossesse. Dans le travail de Haddow, les enfants nés de mère ayant une élévation de TSH au cours du 1er trimestre de la grossesse, présentaient un déficit de 7 points au score de QI à l’âge de 7 à 9 ans, alors que le QI des enfants dont la mère était correctement substituée pendant sa grossesse était normal. Il existait une corrélation entre la sévérité de l’hypothyroïdie maternelle et la diminution du QI chez l’enfant. Conduite à tenir Il est donc très important d’adapter le traitement substitutif des femmes hypothyroïdiennes et de savoir dépister les femmes à risque de développer une hypothyroïdie au cours de la grossesse. Le bilan thyroïdien Son interprétation chez une femme enceinte doit tenir compte des modifications physiologiques induites par la grossesse. Les dosages de T4 et T3 libres sont d’interprétation difficile car les méthodes utilisées en routine correspondent à des estimations, très dépendantes de la concentration des protéines de transport. Des discordances dans les résultats ont pu être notées en fonction des kits de dosage utilisés. En l’absence de références adaptées au terme de la grossesse et à la technique de dosage, le diagnostic repose donc essentiellement sur le dosage de TSH. Les taux de TSH évoluent en miroir des taux d’hCG Les valeurs normales de TSH sont, de ce fait, plus basses chez la femme enceinte et ne doivent pas dépasser 2,5-3 mUI/l en début de grossesse. L’iodurie est majorée au cours de la grossesse et il est difficile d’estimer le statut iodé des femmes enceintes. De ce fait, compte tenu des risques potentiels de la carence iodée, l’OMS recommande un apport d’iode systématique d’au moins 250 μg/j dès la période préconceptionnelle et jusqu’à la fin de l’allaitement. Le traitement Chez les femmes hypothyroïdiennes, la posologie de lévothyroxine est augmentée d’environ 30 % dès que le diagnostic de grossesse est posé. Le taux de TSH sera vérifié un mois après tout changement de posologie, puis toutes les 4 à 6 semaines tout au long de la grossesse, de manière à maintenir un taux ≤ 2,5 mUI/ml au 1er trimestre et 3,5 mUI/ml aux 2e et 3e trimestres. Les situations à risque S’il n’y a pas de consensus sur l’intérêt d’un dépistage systématique de l’hypothyroïdie en début de grossesse, les recommandations sont, en revanche, de doser systématiquement la TSH en début de grossesse chez des femmes considérées comme à haut risque de dysthyroïdie. Il s’agit de patientes présentant des antécédents personnels ou familiaux de maladies thyroïdiennes ou auto-immunitaires : • Antécédent d’hyperthyroïdie, d’hypothyroïdie, de thyroïdite du post-partum ou de lobectomie thyroïdienne. • Présence d’un goitre ou d’anticorps antithyroïdiens positifs. • Signes clinico-biologiques de dysthyroïdie, y compris anémie, hypercholestérolémie et hyponatrémie. • Antécédent familial de pathologie thyroïdienne. • Antécédent de diabète de type 1 ou d’autre pathologie auto-immune. • Hypofertilité. • Antécédent d’irradiation cérébrale ou cervicale. • Antécédent de faussecouche spontanée ou d’accouchement prématuré. Une situation à mentionner concerne les risques de dysthyroïdie lors des stimulations ovariennes. Des bilans thyroïdiens pratiqués au moment de la ponction folliculaire chez des patientes prises en charge en FIV ont permis de mettre en évidence une augmentation significative des taux de TSH comparativement aux taux constatés avant stimulation ovarienne. Ce profil hormonal a été attribué à l’augmentation du taux de TBG liant la T4 et la T3, créant une hypothyroïdie transitoire avant adaptation de la sécrétion thyroïdienne à cette nouvelle situation. Cela n’est pas sans conséquences, notamment chez les femmes présentant des anticorps antithyroperoxydases, dont l’élévation de TSH est plus marquée que celle des témoins. On pourrait donc être amené à substituer ces patientes par lévothyroxine dès la période préconceptionnelle. En conclusion Les conséquences d’une hypothyroïdie maternelle peuvent être sévères pour la mère et l’enfant. La réduction des complications maternelles et foetales passe par une sensibilisation des cliniciens (médecins traitants, obstétriciens, endocrinologues…) amenés à prendre en charge les femmes ayant un désir de grossesse ou déjà enceintes.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :