Publié le 01 déc 2009Lecture 7 min
Infection congénitale à CMV : devenir à long terme
J.-F. MAGNY, Institut de Puériculture et de Périnatalogie, Paris
En 2004, un groupe d’experts réunis pour le compte de l’Agence nationale d’accréditation et d’évaluation en santé(1) a considéré que le dépistage systématique du CMV pendant la grossesse n’est pas justifié, compte tenu, entre autres arguments, de l’insuffisance de données sur les marqueurs pronostiques et sur le devenir des enfants infectés à la naissance.
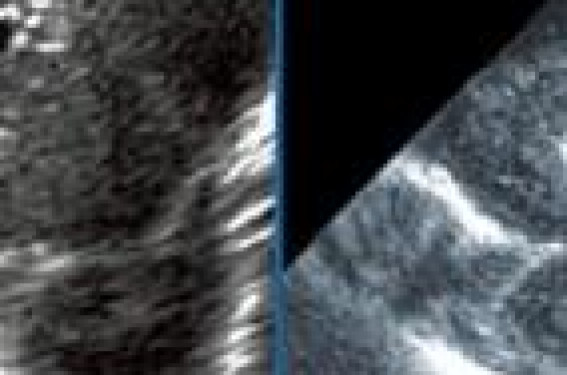
Il s’agit d’une étude rétrospective. Ont été inclus les enfants : – adressés en consultation au cours du premier mois de vie entre septembre 2001 et juin 2007 ; – ayant une infection congénitale à CMV documentée par une culture positive dans les urines, réalisée au cours de la première semaine de vie ; – ayant un suivi échographique anténatal ne révélant aucune anomalie en dehors d’un éventuel retard de croissance intrautérin (RCIU) ; – ayant un examen clinique néonatal normal. L’examen clinique, l’échographie transfontanellaire (ETF) et l’examen du fond d’oeil ont été réalisés au cours de la première consultation. Le programme de suivi a comporté : un examen clinique pédiatrique régulier centré sur l’étude du développement neurologique, associé à une étude de l’audition (tests audiométriques adaptés à l’âge) jusqu’à l’âge de 6 ans. Résultats Soixante-dix-sept enfants ont été inclus ; 16 (20 %) ont été perdus de vue après la première consultation. La séroconversion maternelle en cours de grossesse a été mise en évidence, dans la majorité des cas (88 %), grâce au suivi systématique des sérologies. Quatre fois (6,7 %), c’est l’existence d’un syndrome grippal maternel qui a conduit au diagnostic et 2 fois l’existence de signes foetaux (1 retard de croissance isolé ; 1 hydramnios transitoire isolé). La séroconversion maternelle a eu lieu au cours du 1er trimestre de la grossesse chez 37 % des mères, du 2e trimestre chez 54 % et du 3e trimestre chez 9 %. Un RCIU inférieur au 10e percentile est présent chez 12 enfants (19 %), dont 3 avec retard symétrique de croissance du périmètre crânien. L’échographie cérébrale pratiquée au cours de la consultation postnatale a révélé des anomalies non dépistées en anténatal chez 24,6 % des patients (aspect hyperéchogène en chandelier des vaisseaux thalamiques : 11 ; kyste sousépendymaire : 6 ; kyste du plexus choroïde : 1 ; asymétrie ventriculaire : 1) (figures 1 et 2). Figure 1. Kyste sous-épendymaire. Figure 2. Aspect hyperéchogène « en chandelier » des vaisseaux thalamiques. Aucune choriorétinite n’a été mise en évidence chez aucun patient. La durée médiane du suivi neurodéveloppemental est de 3 ans (1 à 7 ans). Aucun enfant n’a de déficit moteur ou intellectuel. Un déficit auditif a été identifié chez 4 enfants (6,5 %) : bilatéral et profond nécessitant un appareillage chez 1 enfant (1,6 %), unilatéral profond chez 1, et unilatéral modéré chez 2. Les 2 enfants ayant un déficit profond, uni- ou bilatéral, avaient une atteinte dès la période néonatale. L’enfant ayant une surdité appareillée avait un RCIU sans atteinte du périmètre crânien, mais avec, à l’ETF, des kystes sous-épendymaires et un aspect en chandelier des vaisseaux thalamiques. Les 3 enfants, avec un déficit modéré et/ou unilatéral, étaient eutrophiques à la naissance avec des ETF normales. Aucun facteur de risque significatif n’a pu être mis en évidence (trimestre de contamination maternelle, âge gestationnel, sexe, poids et périmètre crânien de naissance, anomalies à l’ETF) (tableau). Sous réserve des petits effectifs, l’existence d’anomalies échographiques cérébrales n’apparaît pas avoir une bonne valeur prédictive positive de déficit auditif (VPP = 6,7 %), mais une valeur prédictive négative satisfaisante (VPN = 93,5 % ; IC95 % : 82-99 %). L’association RCIU + anomalies échographiques cérébrales a une VPP de 50 % (IC : 1,3-98,7 %) et une VPN de 95 % (IC : 86-99 %). Discussion Nous avons retrouvé un taux de déficit auditif dans notre population d’infection congénitale asymptomatique à CMV de 6,5 % avec 1,6 % de déficit profond nécessitant un appareillage. Les études récentes font état de taux comparables (4,7 à 8,1 %) avec 1,8 à 4,9 % de déficit sévère (2-5). Seule l’étude de Foulon publiée en 2008 rapporte un taux de 21 % avec un taux de déficit sévère de 8,7 %, mais la population de cette étude comporte un nombre non précisé d’enfants ayant d’autres facteurs de risque de déficit auditif (6). Certaines études mettent en exergue l’existence de déficit auditif d’apparition secondaire dans un délai pouvant atteindre 6 ans. Cela intéresse 1,3 à 5 % de la totalité des patients, soit 18 à 25 % des enfants avec atteinte auditive (2,3,6). Fowler note que la quasi-totalité des déficits avec un seuil ≥ 30 db sont révélés avant l’âge de 3 ans (7). Des formes d’évolution progressive (11 à 50 % des déficients auditifs) plaident pour un suivi régulier et prolongé des enfants avec atteinte initiale modérée (2,3,6,7). La majorité des études considèrent comme « asymptomatiques » les situations où l’examen clinique néonatal ne montre aucun signe patent d’infection (hépatosplénomégalie, pétéchies, ictère, microcéphalie), sans tenir compte ni d’un éventuel RCIU, ni des données de l’ETF. Dans notre étude, le seul enfant ayant un déficit auditif sévère bilatéral nécessitant un appareillage avait des anomalies échographiques de ce type associées à un RCIU. L’absence d’anomalies échographiques cérébrales apparaît comme un facteur de bon pronostic (VPN de déficit auditif = 94 %). Facteurs de risque Certaines études se sont attachées à rechercher des facteurs de risque d’évolution défavorable. En dehors des signes cliniques d’infection évolutive, qui sont très nettement des facteurs de mauvais pronostic, on retrouve le RCIU et la prématurité (8,9). Les caractéristiques de l’infection maternelle (primo-infection ou réactivation ; terme de la grossesse) font l’objet de résultats disparates (9,10). De nombreuses études récentes ont mis en évidence une différence significative de la charge virale, mesurée au cours du 1er mois de vie, entre les sujets symptomatiques à la naissance et ceux qui sont asymptomatiques (4,8-13). Par ailleurs, des corrélations ont également été retrouvées entre la charge virale et l’apparition de séquelles, chez les enfants symptomatiques comme chez les asymptomatiques. Dépistage L’intérêt du dépistage d’une pathologie asymptomatique ne se justifie que s’il débouche sur une prise en charge améliorant le pronostic. L’intérêt du diagnostic précoce des déficits auditifs sévères, allié à la possibilité de forme retardée et/ou progressive de ces déficits dans le cadre de l’infection à CMV, plaide en faveur du dépistage. Cependant, il faut certainement mieux cibler la population à suivre et affiner les modalités de ce suivi. Les enfants sans signe clinique, mais avec un RCIU et surtout des anomalies échographiques cérébrales, sont certainement à suivre pendant une durée de 5 ans, ainsi, probablement, que ceux totalement asymptomatiques ayant une charge virale élevée à la naissance > 104 copies/ml). Pour les autres, la surveillance peut très probablement être allégée, se limiter à 3 ans, sauf s’ils révèlent avant cet âge un déficit quel qu’il soit. Traiter ou ne pas traiter ? Pour les enfants plus à risque, se pose la question du traitement (14). Le seul traitement disponible actuellement est le ganciclovir administré par voie intraveineuse pendant 6 semaines. Une seule étude randomisée chez les enfants symptomatiques avec atteinte du système nerveux central est disponible (15). Elle conclut à une prévention de la détérioration de la fonction auditive significative chez les enfants traités. Cependant, il s’agit d’un traitement lourd à haut risque d’effets secondaires et la balance bénéfice/ risque chez le sujet asymptomatique, même avec facteur de risque tel qu’une charge virale élevée, ne paraît pas en faveur d’une indication de ce traitement. Le valganciclovir, administrable per os, aurait une meilleure innocuité. Mais il n’a, à ce jour, fait l’objet que d’une seule étude en relais d’un traitement intraveineux.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :