Publié le 25 nov 2009Lecture 15 min
Fibrome utérin. Comment diagnostiquer ? Comment surveiller ?
J. de LAVEAUCOUPET, Hôpital Antoine Béclère, Clamart
Le diagnostic de fibrome utérin repose sur l’échographie par voie sus-pubienne et endovaginale 2 D et 3 D avec Doppler. L’IRM est la technique la plus efficace pour quantifier le nombre exact de fibromes, préciser leur topographie, leur caractérisation tissulaire et leur vascularisation. Ces techniques d’imagerie permettent d’orienter vers le choix thérapeutique le plus adapté, en particulier chez une femme en âge de procréer.
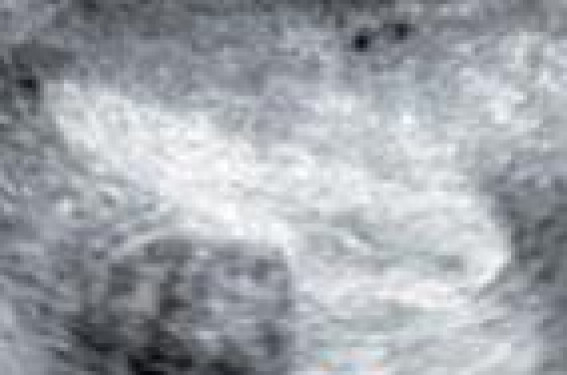
Il s’agit d’une pathologie très fréquente développée pendant la période d’activité génitale, intéressant environ 30 % des femmes de plus de 35 ans. Le fibrome utérin est une tumeur bénigne bien circonscrite, sans capsule, constituée de fibres musculaires lisses et de tissu conjonctif. L’hyperestrogénie est le terrain habituel. Cliniquement, les fibromes se traduisent par des ménorragies et/ou méno-métrorragies, des douleurs pelviennes ou, plus rarement, par un syndrome de masse. Ils peuvent être asymptomatiques, de découverte fortuite à la suite d’un examen clinique retrouvant un utérus volumineux ou d’une échographie. L’échographie est l’examen diagnostique de référence pour le diagnostic des fibromes ; l’hystéroscopie est indiquée pour apprécier leur retentissement intracavitaire. Seuls les fibromes symptomatiques sont traités. Le but de l’imagerie est d’orienter la stratégie thérapeutique dont les modalités sont les suivantes : traitement médical, chirurgie conservatrice (myomectomie par laparotomie, par voie coelioscopique ou hystéroscopique) ou chirurgie radicale (hystérectomie), traitement par embolisation, technique combinée associant embolisation et chirurgie élective des fibromes et, modalité plus récente, thermo-ablation par ultrasons focalisés sous IRM. Cette évaluation préthérapeutique est effectuée par échographie ou, au mieux, par IRM pelvienne. Afin de s’orienter vers le traitement le plus adapté, l’imagerie droit répondre à différentes questions : – quels sont le nombre, la localisation, la taille du (ou des) fibrome(s) ? – s’agit-il d’un ou de fibromes simples ou compliqués ? – quel est le type de vascularisation du (ou des) fibrome(s) ? – quels sont les diagnostics différentiels et y a-t-il des lésions associées ? Comment diagnostiquer ? Échographie Elle reste la technique de choix pour l’exploration du pelvis féminin en première intention. Elle permet le diagnostic des fibromes suspectés cliniquement et la détection des fibromes asymptomatiques. Les voies suspubienne et endovaginale 2 D, au mieux 3 D, doivent toujours être associées successivement, la première à type de repérage, la seconde pour une meilleure définition du ou des fibromes. L’échographie permet de préciser leur échostructure, leur localisation et leur volume ; ces précisions sont nécessaires avant d’envisager un traitement chirurgical par voie hystéroscopique. Échostructure Les fibromes se présentent comme des nodules arrondis ou ovalaires dont l’échogénicité est variable, fonction de leur contingent tissulaire solide et de leur remaniement interne hémorragique, oedémateux ou nécrotique. Le plus souvent, il s’agit d’un nodule hypoéchogène homogène, à contours réguliers, facilement délimité par le myomètre sain adjacent (figure 1) ; parfois, les fibromes sont hétérogènes avec des plages hyper- et hypoéchogènes en fonction du degré de fibrose, ou ils peuvent contenir des plages franchement anéchogènes en cas de dégénérescence kystique ; ils peuvent être calcifiés, soit en périphérie, soit entièrement, ce qui se traduit alors par une image arciforme avec cône d’ombre (figure 2). Le Doppler couleur permet la délimitation des lésions grâce à la visualisation de la couronne vasculaire périphérique située dans la pseudo-capsule (figure 3). Figure 1. Utérus en coupe sagittale 2D. Fibrome hypoéchogène. Figure 2. Utérus en coupe sagittale 2D. Fibrome calcifié en périphérie. Figure 3. Utérus en coupe axiale 2D avec Doppler. Vascularisation périphérique du fibrome. Topographie et quantification Figure 4a. Échographie 3 D de l’utérus. Mode triplan. Myome intracavitaire type 0. Figure 4b. Échographie 3 D de l’utérus. Agrandissement de la coupe coronale. Il est important de préciser la situation des myomes par rapport à l’endomètre et la séreuse utérine. L’échographie permet de préciser le siège sous-muqueux, interstitiel et sous-séreux du fibrome. – Les myomes sous-séreux déforment les contours utérins en donnant une image d’addition ; ils peuvent poser des problèmes diagnostiques lorsqu’ils sont pédiculés, pouvant être interprétés comme un1e masse annexielle ; le Doppler couleur aide au diagnostic en montrant des vaisseaux dans le pédicule du myome. – Les myomes interstitiels ou intramuraux sont situés dans l’épaisseur du myomètre, entourés de parenchyme sain les séparant de l’endomètre ou de la face externe de l’utérus ; lorsqu’ils sont volumineux, ils intéressent toute l’épaisseur du myomètre et présentent alors un dôme sous-séreux et/ou un dôme sous-muqueux. - Les myomes sous-muqueux refoulent et étirent l’endomètre. L’échographie permet de préciser l’importance de la composante intracavitaire qui est classée en trois types. L’échographie 3 D apparaît très utile pour l’analyse des rapports avec l’endomètre dans les trois plans (figure 4). Lorsqu’il existe plusieurs myomes, les coupes coronales facilitent la visualisation des différentes localisations sous-séreuses, intramurales ou sous-muqueuses des fibromes. L’hystérosonographie permet une étude plus précise des rapports entre myome sousmuqueux et endomètre, grâce au décollement des deux faces de l’endomètre par le sérum salé qui vient alors mouler les fibromes à extension endocavitaire (figure 5). Figure 5. Hystérosonographie 3 D de l’utérus. Mode multiscan. Myome intracavitaire de type 1. Figure 6. Critères de résécabilité par voie hystéroscopique : taille du fibrome < 5 cm, mur postérieur de sécurité > 5 mm. Biométrie des fibromes et quantification Ces précisions sont nécessaires, en particulier si on envisage une résection chirurgicale par voie hystéroscopique. Ces critères de résection sont : diamètre du fibrome sous-muqueux < 5 cm et mur postérieur de sécurité ≥ 5 mm (figure 6). Apport de l’IRM L’échographie peut être limitée si l’utérus est volumineux et/ou s’il existe plus de quatre localisations fibromateuses. L’IRM apparaît alors comme une technique complémentaire très intéressante pour réaliser la cartographie des différents fibromes, permettre leur caractérisation tissulaire et préciser leur type de vascularisation, en particulier si on envisage un traitement par embolisation. Un des avantages de l’IRM, comparativement à l’échographie, est son excellente reproductibilité inter-observateur. En pratique, on réalise des séquences en pondération T2 dans le plan coronal et sagittal, en pondération T1 dans le plan axial, sans, puis après injection de gadolinium, en général avec suppression du signal de la graisse pour mieux délimiter les contours des fibromes. Il apparaît en hyposignal net T2, et en isosignal comparativement au myomètre en T1 (figure 7). Après injection de gadolinium, le rehaussement est globalement homogène, parallèle au myomètre. Figure 7. IRM de l’utérus. Coupe sagittale en pondération T2. Utérus volumineux siège de plusieurs fibromes en hyposignal T2. Différents types de remaniements de fibrome peuvent être différenciés, grâce à l’étude du signal en T1 et T2 en IRM : – le remaniement oedémateux : il débute en périphérie où il va se traduire par un anneau en hyposignal T1, hypersignal T2 autour du fibrome ; – le remaniement hémorragique : commençant également en périphérie du fibrome, il apparaît sous forme d’un anneau périphérique en hypersignal T1 hyper-signal T2 Figure 8. IRM de l’utérus. Coupe axiale en pondération T1 (a) et T1 avec saturation de la graisse (b) : fibrome en remaniement hémorragique en hypersignal T1 périphérique. d’épaisseur variable (figure 8) ; – la kystisation correspond à une transformation liquidienne du fibrome, se traduisant par un signal liquidien : hyposignal T1, hypersignal T2 sans prise de contraste (figure 9) ; – les remaniements nécrotiques sont d’installation le plus souvent aiguë ou subaiguë, secondaires à des remaniements hémorragiques successifs. Cette transformation est plus fréquente en cas de grossesse, touchant environ 10 % des fibromes chez la femme enceinte, et également décrite avec la prise de contraceptifs. Cette forme est responsable de signes systémiques à type de fièvre et syndrome inflammatoire ; dans ce cas, le centre du fibrome apparaît en hypersignal T2 et hyposignal T1 variable avec un rehaussement périphérique (figure 10) ; – D’autres remaniements peuvent correspondre à une forme de vieillissement de fibrome : hyalinisation focale ou généralisée, remaniements myxoïdes, infiltration graisseuse (l’aspect IRM en hypersignal T1 est à différencier de remaniement hémorragique par le recours aux séquences en suppression de graisse), remaniements calciques ; – une forme particulière de fibrome est représentée par une lésion comportant une proportion élevée de cellules musculaires lisses avec une faible quantité de matrice extracellulaire, et une vascularisation plus riche ; ces fibromes dits « cellulaires » ont la particularité de présenter un hypersignal marqué en pondération T2 et d’être rehaussés de façon intense après injection de gadolinium (figure 11). Figure 9. IRM de l’utérus. Coupe axiale en pondération T2. Fibrome en dégénérescence kystique. Comme en échographie, l’IRM permet de préciser la cartographie et la distance des fibromes par rapport à la cavité utérine et la séreuse utérine pour juger des possibilités de résection endoscopique (figure 12). L’embolisation sera réservée aux fibromes interstitiels avec possibilité de suivre l’évolution des fibromes par IRM. Le caractère sousséreux des fibromes orientera vers un traitement chirurgical par voie coelioscopique ou par laparotomie ; en cas de fibromes pédiculés, l’IRM précisera l’étroitesse des pédicules car ils présentent un risque de torsion. L’IRM permet également de diagnostiquer des localisations rares de fibromes de diagnostic difficile par échographie seule : col utérin, paramètres, ligament large, ligament utéro-sacré (figure 13). Enfin, un autre intérêt de l’IRM est la visualisation d’une éventuelle compression de la vessie et des uretères, du rectum et des vaisseaux iliaques. Autres diagnostics et pathologies associées Figure 10. IRM de l'utérus. Fibrome en nécrobiose. a. sagittale T2 : fibrome en hypersignal hétérogène. b. sagittale T1 avec injection de gadolinium : rehaussement de la portion solide. Adénomyose C’est le principal diagnostic différentiel du fibrome. Il s’agit de greffe ectopique de tissu endométrial (glandes et chorion) dans le myomètre correspondant à un phénomène probablement physiologique se développant avec l’âge, puisqu’il est présent chez près de 50 % des femmes après 40 ans. Cette pathologie utérine bénigne a longtemps été sousestimée, car confondue avec un gros utérus dit fibromateux. Elle peut être retrouvée seule ou associée à des fibromes utérins. Il existe deux types d’adénomyose : l’adénomyose diffuse et la forme localisée, appelée adénomyome. Figure 11. IRM de l’utérus. Fibrome « cellulaire ». a. sagittale T2 : fibrome en hypersignal. b. sagittale T1 avec injection de gadolinium : rehaussement intense du fibrome. La forme diffuse est évoquée devant un utérus augmenté de volume, le plus souvent aux dépens de sa face postérieure, présentant une échostructure hétérogène, sous forme d’une plage intramyométriale sans délimitation nette avec le myomètre sain périphérique, siège de structures glandulaires microkystiques de 3 à 4 mm, ou présentant en échographie un aspect hétérogène sous forme d’un piqueté hyperéchogène avec aspect en mie de pain. Dans la forme localisée ou adénomyome, l’échographie retrouve une zone nodulaire hétérogène à contours flous posant le diagnostic différentiel avec un myome ; l’étude Doppler couleur montre alors une vascularisation normale conservée avec aspect radiaire des vaisseaux traversant l’adénomyome vers l’endomètre sans signe de refoulement. Le diagnostic en IRM repose sur des critères bien décrits : utérus augmenté de volume avec développement parfois asymétrique de l’une de ses faces, épaississement focal ou diffus de la zone jonctionnelle, siège de spots hyperintenses en T2 et parfois T1, correspondant aux dilatations kystiques des foyers endométriaux ectopiques qui peuvent être le siège de remaniements hémorragiques (figure 14). Figure 12. IRM de l’utérus. Coupe sagittale T2 : fibrome sous-muqueux. Autres diagnostics Une endométriose profonde doit être recherchée en cas de symptomatologie douloureuse dominante, pouvant être associée à l’adénomyose dans 30 % des cas. Un polype muqueux à large base d’implantation est à évoquer devant une masse intracavitaire ; son diagnostic peut être fait par le Doppler énergie qui montre la vascularisation de son pédicule. L’hystérosonographie augmente la sensibilité et la fiabilité du diagnostic échographique des polypes en permettant leur expansion intracavitaire. Toutefois, le traitement étant identique pour le fibrome sous-muqueux intracavitaire et le polype (résection endoscopique), une différenciation préopératoire entre ces deux entités présente peu d’intérêt. Les sarcomes utérins peuvent être confondus avec une pathologie fibromateuse car ils se manifestent par la même symptomatologie. Parmi eux, le léïomyosarcome réalise une lésion circonscrite souvent volumineuse, se présentant en échographie et IRM comme un gros fibrome remanié. Figure 13. IRM de l’utérus. Coupe axiale T2 : fibrome du ligament large. U : utérus. Toutefois, en IRM, certains critères orientent vers la malignité : contours irréguliers, plages de nécrose tumorale en hypersignal T2, hémorragie intralésionnelle en hypersignal T1, prise de contraste intense et hétérogène, présence d’adénopathies des chaînes iliaques (figure 15). Figure 14. IRM de l’utérus. Coupe sagittale T2. Adénomyose. Figure 15. IRM de l’utérus. Coupe sagittale T2. Sarcome utérin. Les fibromes sous-séreux pédiculés peuvent faire évoquer la possibilité de masses annexielles, en particulier ovariennes (fibrome ovarien). La visualisation de deux ovaires normaux et la mise en évidence d’un pédicule vasculaire naissant de l’utérus permet de redresser le diagnostic. Comment surveiller ? L’échographie seule permet la surveillance des fibromes peu ou non symptomatiques, non traités. Le rythme de cette surveillance sera fonction de l’évolution de la symptomatologie clinique. L’IRM apparaît la technique de choix pour la surveillance des fibromes après traitement conservateur. L’IRM est utilisée dans le monitorage de l’efficacité des analogues de la GnRH pour évaluer la réduction en taille des fibromes. Figure 16. IRM de l’utérus. Artériographie utérine (a). Coupe axiale T1 après injection de gadolinium (b). a. Utérus polymyomateux traité par embolisation. b. IRM à 6 mois : dévascularisation des fibromes. Seuls les fibromes cellulaires réagissent au traitement médical, alors que les fibromes dégénérés montrent peu de réponse. Toutefois, l’hyperestrogénie induite par les agonistes ne permet pas une utilisation prolongée (risque de déperdition osseuse) et leur effet est transitoire avec réapparition des symptômes et retour au volume utérin et fibromateux initial 6 à 12 mois après l’arrêt du traitement. En cas de traitement par embolisation utérine, l’aspect IRM des fibromes est caractérisé par une nécrose hémorragique : leur centre devient hyperintense en T1 sans et avec suppression de graisse (figure 16). L’IRM est pratiquée pour évaluer le volume et la dévascularisation des fibromes : une IRM à 6 mois et à 1 an est proposée. L’IRM possède une bonne valeur prédictive positive quant au risque de récidive ; l’existence d’une zone de rehaussement en calotte sphérique à la périphérie d’un fibrome après injection de gadolinium doit faire attendre une repousse du fibrome dans environ 60 % des cas après 3 ans de recul. Après myomectomie par voie abdominale, le risque de récidive se situe aux alentours de 10 % à 5 ans ; ce risque semble augmenter après myomectomie par voie coelioscopique car les exérèses de petits fibromes ne sont pas réalisées. Ces récidives sont diagnostiquées par l’échographie pelvienne pratiquée en fonction de la symptomatologie clinique. EN PRATIQUE • L’échographie 2 D, au mieux associée au 3 D, est l’examen de référence pour le diagnostic des fibromes utérins : elle permet de compter les myomes, d’évaluer leur volume, d’apprécier leur situation sous-muqueuse, interstitielle et sous-séreuse, et de préciser le rapport des myomes avec la cavité utérine en dedans et avec la séreuse en dehors. • Lorsque l’échographie est limitée par la taille de l’utérus et le nombre des fibromes, l’IRM intervient pour la cartographie exacte des fibromes, leur caractérisation tissulaire – fibrome simple ou remanié, type de remaniement – et leur degré de vascularisation ; elle aide au diagnostic différentiel avec l’adénomyose, le léïomyosarcome et les masses annexielles. • Le but de l’imagerie est de proposer la stratégie thérapeutique la mieux adaptée : traitement médical, chirurgical radical ou conservateur, embolisation. • Elle permet de suivre le volume et la dévascularisation des fibromes après traitement médical ou par embolisation.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :