Publié le 30 nov 2008Lecture 10 min
Diagnostic préimplantatoire et anomalie chromosomique
P. GOSSET, Laboratoire de Biologie de la Reproduction, CHU de Strasbourg
Le diagnostic préimplantatoire (DPI) est une technique particulière de diagnostic prénatal qui est réalisée sur l’embryon in vitro, avant son transfert dans l’utérus pour une éventuelle grossesse. Ce diagnostic est proposé lorsque le couple de-mandeur est susceptible de transmettre une maladie héréditaire d’une particulière gravité, d’origine génétique ou chromosomique. Les chances de réussite sont bonnes si l’indication est posée à temps.
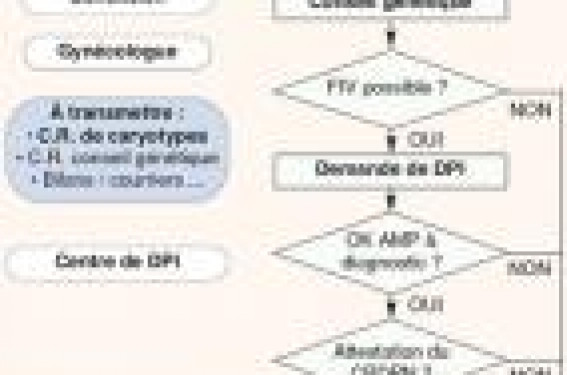
Rappels sur le DPI Le DPI consiste à effectuer un diagnostic biologique sur l’embryon in vitro. C’est une technique récente, très encadrée sur le plan légal. Il n’est autorisé qu’à titre exceptionnel, à condition « qu’un médecin exerçant son activité dans un centre de diagnostic prénatal pluridisciplinaire… atteste que le couple, du fait de sa situation familiale, a une forte probabilité de donner naissance à un enfant atteint d'une maladie génétique d'une particulière gravité reconnue comme incurable au moment du diagnostic », selon l’article L.2131-4 du code de la santé publique. Les termes de cette définition ermettent de déterminer le hamp d’application de cette echnique qui couvre les maladies éréditaires dues à des nomalies dans un gène (mutations), es anomalies chromosomiques qui touchent un rand nombre de gènes), mais eut aussi comprendre des cas e figure moins évidents dès u’une pathologie grave résulte e caractères hérités. En ce qui concerne les demandes abituelles, la forte obabilité d’avoir un enfant tteint est facilement établie, uisque le risque est d’un mbryon atteint sur quatre pour es pathologies récessives et ’un embryon sur deux pour les athologies dominantes. Indications du DPI our anomalies hromosomiques On observe que les anomalies hromosomiques constituent nviron la moitié des demandes e DPI et on estime que 300 couples ourraient être concernés ar cette technique, chaque nnée, en France. ela ne représente qu’une partie es couples à risque si on considère e fait qu’à la naissance, nviron une personne sur 200 st porteuse d’une anomalie hromosomique, dont l’impact hénotypique est variable. Théoriquement, le risque pour a descendance est plus élevé si la translocation concerne des petits fragments ou si l’inversion est de grande taille, ce qui équivaut à un petit échange des extrémités du même chromosome. En revanche, le déséquilibre étant modéré, ces cas sont aussi ceux qui ont le plus de chance de donner des grossesses. En effet, lorsque les fragments transloqués sont de grande taille, le déséquilibre est fréquent et important, les chances de grossesse évolutive sont faibles, le risque de naissance d’un enfant porteur d’une anomalie est donc modéré. On peut estimer qu’en moyenne 30 % des embryons seront porteurs d’un déséquilibre si un des parents a une translocation Robertsonienne, 50 % s’il s’agit d’une translocation réciproque, mais il existe une grande variabilité selon les cas. Les connaissances sur la ségrégation des chromosomes transloqués ne sont pas suffisantes pour faire une estimation de grande précision du risque, qui doit être annoncé avec prudence. Si besoin, lorsque c’est le père qui porte l’anomalie, le nombre de gamètes porteurs d’un déséquilibre peut être déterminé par comptage en hybridation in situ fluorescente (FISH) sur spermatozoïdes. Au total, les meilleures chances de succès du DPI sont rencontrées chez des couples fertiles, notamment lorsque la femme est jeune, s’il existe un fort risque de déséquilibre dans la descendance et à condition que la proportion d’embryons « sains » reste suffisamment élevée. La demande, en pratique… Il arrive assez souvent qu’une anomalie chromosomique soit découverte à l’occasion d’un examen prénatal, ou dans le bilan d’une infertilité. Le rôle du gynécologue ayant prescrit le caryotype sera, dans un premier temps, de présenter ce résultat aux patients et de donner les premières explications (figure 1). Figure 1. Déroulement de la demande de DPI Il est conseillé de renvoyer ensuite les deux membres du couple devant un confrère généticien qui pourra leur donner, en consultation de conseil génétique, des informations sur les tenants et aboutissants de l’anomalie découverte, notamment son origine, la nécessité de faire une enquête familiale, les risques pour eux-mêmes et leur descendance ainsi que sur les moyens qui existent pour les éviter. Le généticien peut, éventuellement, donner une estimation du risque de naissance d’un enfant porteur d’une anomalie déséquilibrée, ainsi que de la proportion attendue d’embryons qui seront sains. Le couple « à risque » qui envisage d’avoir des enfants doit avoir reçu toutes les informations nécessaires pour choisir entre les différents moyens qui lui sont proposés : diagnostic prénatal, préimplantatoire, don, adoption, etc. Si le couple opte pour le DPI, un bilan visant à estimer la faisabilité de la FIV, en particulier par estimation de la réserve ovarienne, pourra être demandé par le gynécologue. S’il est possible d’obtenir au moins 10 à 12 ovocytes par cycle de DPI, les chances de succès sont bonnes. Au-dessous de 6 follicules, les chances sont faibles et les tentatives sont généralement interrompues. La moitié des dossiers rejetés en DPI le sont pour impossibilité de faire une FIV dans de bonnes conditions. Le couple peut ensuite être adressé à un centre de DPI à Paris, Montpellier ou Strasbourg. Les éléments préliminaires de dossier envoyés doivent comprendre au moins la copie du caryotype montrant l’anomalie, le compte-rendu de la consultation de conseil génétique et tous les éléments disponibles qui permettent d’évaluer la faisabilité de la FIV. Ces éléments sont évalués par le centre de DPI et, s’ils permettent d’envisager le diagnostic avec de bonnes chances de réussite, le dossier est présenté au Centre pluridisciplinaire de diagnostic prénatal (CPDPN), auquel participe le praticien ayant l’agrément pour le DPI. Le CPDPN doit fournir une attestation pour chaque demande, établissant que celle-ci répond bien aux exigences légales. À ce point, certains dossiers peuvent provoquer de longs débats, notamment lorsqu’il est difficile d’évaluer la fréquence des cas supposés graves dans la descendance. Parallèlement, la technique d'analyse du DPI doit être adaptée pour pratiquement chaque couple. Il faut, au minimum, plusieurs semaines de développement pour mettre au point une de ces techniques qui sont optimisées, afin de pouvoir réaliser le diagnostic sur un matériel minimal, une seule cellule, dans un temps court de quelques heures, avec les plus grandes sensibilité et spécificité possibles. Tous les éléments précédents étant réunis, s’il n’y a pas de difficulté sur le plan clinique ou diagnostique, le DPI pourra être programmé selon les disponibilités du centre. Dans l’état actuel des choses, l’ensemble de la démarche peut facilement prendre une année, voire plus. De nombreux efforts étant faits pour répondre plus rapidement à la demande, il convient de se renseigner directement auprès du centre de DPI pour connaître les délais en cours. Figure 2. Déroulement d’un cycle DPI. Déroulement d’un DPI Le traitement de stimulation hormonale Il est effectué à proximité du domicile du couple par un gynécologue habitué à l’AMP en collaboration étroite avec le centre de DPI (figure 2). À maturité folliculaire, la ponction ovarienne est faite dans le centre de DPI. La fécondation des ovocytes dénudés est faite par injection intracytoplasmique de spermatozoïdes (ICSI) afin d’éviter toute contamination de l’analyse par de l’ADN d’origine maternelle provenant des cellules de la corona radiata, ou paternelle, des spermatozoïdes. Au 3e jour d'évolution, les embryons qui ont au moins 6 à 8 cellules sont biopsiés au micromanipulateur. L’embryon étant maintenu, la membrane pellucide est perforée par un moyen mécanique, chimique (acide tyrode) ou par un laser. Une ou deux cellules sont prélevées par aspiration à la pipette et sont préparées pour la technique d’analyse (figure 3). Figure 3. Biopsie embryonnaire. L’embryon est replacé en étuve jusqu’au lendemain. Pendant ce temps, l’analyse est effectuée. Deux types de techniques sont employés dans leDPI. Pour la recherche des mutations, on utilise la biologie moléculaire, à base d’amplification de l’ADN par (PCR), qui permet de rechercher les mutations ou les marqueurs (points de repère sur l’ADN) qui y sont associés. Pour étudier les anomalies chromosomiques, on recourt à la cytogénétique moléculaire (FISH), qui permet de visualiser par des sondes les chromosomes dans le noyau de la cellule en interphase et de les compter (figure 4). Au 4e jour, le couple est revu pour lui communiquer les résultats et, s’il y a un ou des embryons sains, faire le transfert et/ou les congeler. Des informations sont également données sur la qualité de l’analyse, notamment sur la certitude du résultat qui est annoncé. L’analyse biologique étant pratiquée sur un matériel minimal, dans un temps court, sans vérification possible, il persistera toujours un petit risque d’erreur ou d’incertitude. De plus, il faut rappeler qu’il persiste un risque d’anomalie génétique ou chromosomique en dehors de celui pour lequel le DPI a été spécifiquement autorisé, ce qui exclut, entre autres, la recherche de trisomie 21 pour âge maternel élevé. En cas de grossesse, ces données seront importantes pour le couple qui sera amené à réfléchir sur l’intérêt de réaliser un diagnostic prénatal relativement au risque de perdre la grossesse à cause du prélèvement. Après transfert, les chances de grossesse avoisinent les 30 %, ce qui replace le couple dans la moyenne habituelle de réussite de la FIV. Figure 4. Principe de l’analyse d’une translocation réciproque en DPI. Pour cette analyse, trois sondes sont nécessaires. Ici, elles sont marquées en rouge, vert et bleu. Les embryons au caryotype équilibré, qui peuvent être transférés, montrent deux signaux pour chaque sonde dans les noyaux étudiés. Les embryons au caryotype normal ne sont pas différentiés de ceux qui portent la translocation équilibrée. POINTS À RETENIR Le recours au DPI doit être proposé aux couples lorsqu’il est envisageable de mener une fécondation in vitro, d’autant plus que le risque de naissance d’un enfant au caryotype déséquilibré est élevé, ce qui arrive le plus souvent pour les petites translocations. La consultation de conseil génétique permet de répondre aux questions des patients et, éventuellement, de préciser le niveau de risque pour leur descendance et le reste de leur famille. Les chances de réussite du DPI dépendent aussi très fortement de la fécondité du couple, en premier lieu de l’âge de la femme. Il est donc primordial de dépister le plus tôt possible les couples susceptibles de recourir au DPI, afin de les informer de cette possibilité, évaluer la faisabilité de la technique, les prendre en charge dans un des trois centres et leur laisser suffisamment de temps pour faire plusieurs tentatives si besoin. Dans ces conditions, le diagnostic préimplantatoire donne de très bons résultats.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :