Sénologie
Publié le 30 nov 2009Lecture 10 min
Cancer du sein : de la prédisposition au risque
A. FAJAC, Hôpital Tenon, Paris
Évaluer au mieux le risque de cancer du sein d’une femme constitue l’étape préalable à sa prise en charge adaptée. Cette notion de risque de cancer du sein est à distinguer de la probabilité pour une femme d’être porteuse d’une mutation constitutionnelle délétère sur un gène de prédisposition au cancer du sein. Plusieurs modèles de prédiction du risque ont été développés, dont certains permettent aussi de calculer la probabilité de mutation des gènes de prédisposition au cancer du sein et de l’ovaire BRCA1 et BRCA2. Ces principaux modèles et les recommandations de prise en charge d’une femme à haut risque de cancer du sein et sans mutation dans un gène de prédisposition identifiée, situation plus fréquente en pratique clinique que celle d’une femme à haut risque avec mutation identifiée, sont les deux thèmes abordés ici.
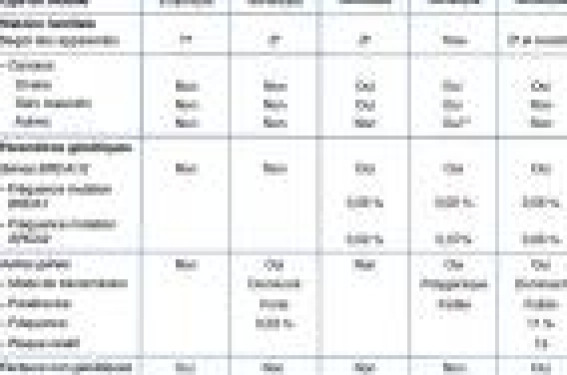
Le risque de cancer du sein de la population générale, c’està- dire la probabilité qu’a une femme de développer un cancer du sein durant sa vie, est d’environ 10 %. Cependant, le risque de cancer du sein dépend de divers facteurs, variables d’une femme à l’autre, et ce risque de 10 % n’est donc qu’une valeur moyenne. Principaux modèles de prédiction du risque Les principaux modèles de calcul de risque de cancer du sein sont, du plus ancien au plus récent, les modèles de Gail (1), de Claus (2), BRCAPRO (3), BOADICEA (Breast and Ovarian Analysis of Disease Incidence and Carrier Estimation Algorithm) (4) et de Tyrer-Cuzick (5). Les trois modèles les plus récents (BRCAPRO, BOADICEA et de Tyrer-Cuzick) permettent aussi de calculer la probabilité de mutation des gènes BRCA1 et BRCA2. Ces modèles prennent en compte différents paramètres qui peuvent être classés en trois grandes catégories : l’histoire familiale, les paramètres génétiques et les facteurs de risque non génétiques (tableau). Les paramètres génétiques désignent les caractéristiques spécifiquement génétiques entrant dans la construction du modèle, à savoir le mode de transmission des gènes de prédisposition au cancer du sein, la fréquence des mutations de ces gènes dans la population générale et leur pénétrance. On distingue les modèles dits « empiriques » de ceux dits « génétiques », ces derniers étant construits en intégrant les paramètres génétiques. Les modèles génétiques peuvent s’appliquer à n’importe quel type d’histoire familiale (prise en compte de la structure familiale avec la répartition des cas de cancer et des femmes indemnes). En revanche, les modèles empiriques ne comportent pas de paramètre spécifiquement génétique et ne prennent en compte que certains points de l’histoire familiale (comme le nombre d’apparentés atteints, l’âge au diagnostic de cancer dans la famille). Les modèles cités ci-dessus sont tous des modèles génétiques à l’exception du modèle de Gail. Histoire familiale Seul le modèle BOADICEA considère l’ensemble des apparentés, le modèle de Gail ne considérant que les apparentés au premier degré et les autres modèles (Claus, BRCAPRO, Tyrer-Cuzick) les apparentés au premier et second degrés. Le cancer de l’ovaire n’est pas pris en compte par les modèles de Claus et Gail. Quant au cancer du sein masculin, il n’est inclus que dans les modèles BRCAPRO et BOADICEA. Le modèle BOADICEA considère aussi les cancers de la prostate et du pancréas de la famille. Paramètres génétiques Les gènes BRCA1 et BRCA2 ont été intégrés dans la construction des modèles BRCAPRO, BOADICEA et de Tyrer-Cuzick, avec des fréquences de l’allèle muté dans la population générale variant selon le modèle de 0,05 à 0,06 % pour BRCA1 et de 0,02 à 0,07 % pour BRCA2. Par ailleurs, pour une famille donnée, les résultats de la recherche de mutation des gènes BRCA1 et BRCA2 (présence ou absence de mutation), s’ils sont disponibles, sont entrés dans ces modèles. L’absence de détection de mutation dans une famille est donc considérée pour le calcul du risque de cancer du sein d’une femme donnée. D’autres gènes que BRCA1 et BRCA2 sont pris en compte par les modèles de Claus, BOADICEA et de Tyrer-Cuzick. Le modèle de Claus, développé avant le clonage des gènes BRCA1 et BRCA2, repose sur la transmission autosomique dominante d’un allèle rare au niveau d’un seul locus avec une fréquence de 0,33 %. Dans le modèle BOADICEA, les effets de multiples gènes à faible pénétrance et de gènes modificateurs sur le risque de cancer du sein sont considérés. Quant au modèle de Tyrer- Cuzick, il fait l’hypothèse de l’existence d’un gène transmis sur le mode dominant dont la fréquence de l’allèle muté est de 11 % et la pénétrance faible. Facteurs de risque non génétiques L’âge de la femme dont on doit déterminer le risque de cancer du sein est intégré dans tous les modèles. Figure 1. Recommandations françaises de prise en charge des femmes à haut risque de cancer du sein sans mutation BRCA et BRCA2 identifiée. Mais seuls les modèles de Gail et Tyrer- Cuzick tiennent compte d’autres facteurs de risque non génétiques. Dans le modèle de Gail, il s’agit de l’âge aux premières règles, l’âge à la première naissance vivante, le nombre de biopsies mammaires bénignes, la présence de lésions d’hyperplasie atypique. Le modèle de Tyrer- Cuzick intègre ces mêmes paramètres et en ajoute d’autres : le nombre d’enfants, l’âge à la ménopause, la prise d’un traitement hormonal substitutif, la présence d’un carcinome lobulaire in situ et l’indice de masse corporelle. Recommandations de prise en charge Les recommandations françaises pour la prise en charge d’une femme à haut risque de cancer du sein sans mutation des gènes BRCA1 et BRCA2 identifiée sont essentiellement celles de l’Expertise collective Inserm-FNCLCC (6) et celles de Saint-Paul de Vence (7) (figure 1). Elles portent sur la surveillance clinico-radiologique mammaire, la mastectomie et l’annexectomie bilatérales prophylactiques. À titre de comparaison, les recommandations de prise en charge d’une femme porteuse d’une mutation des gènes BRCA1 ou BRCA2 sont rassemblées dans la figure 2. Surveillance clinicoradiologique mammaire Chez les femmes sans mutation identifiée, les recommandations de l’Expertise collective et de Saint-Paul sont basées sur une probabilité de mutation, et non sur un niveau de risque de cancer du sein, avec des seuils différents, 10-15 % et 30 %, respectivement. Les modèles utilisables pour calculer la probabilité de mutation ne sont précisés que par les experts de Saint-Paul, le modèle suscité BRCAPRO étant mentionné. Selon l’Expertise collective, pour une probabilité de mutation supérieure à 10-15 %, un examen clinique 2 à 3 fois/an à partir de 20 ans et une échographie + une mammographie annuelles à partir de 30 ans sont recommandés. Figure 2. Recommandations françaises de prise en charge des femmes porteuses de mutation BRCA1 ou BRCA2. La place de l’IRM reste à définir. Selon les recommandations de Saint-Paul, pour une probabilité de mutation supérieure à 30 %, une surveillance identique à celle des femmes porteuses de mutation est préconisée comprenant une IRM annuelle à partir de 30 ans, outre l’examen clinique 2 fois/an et l’échographie annuelle, examens tous deux réalisés à partir de 25 ans, et une mammographie annuelle à partir de 30 ans. Lorsque la probabilité de mutation est inférieure à 30 %, les modalités de surveillance sont aussi définies dans les recommandations de Saint-Paul, mais sans que soit précisée une limite supérieure. Il est recommandé d’effectuer, à partir de 40 ans ou 5 ans avant l’âge du cas le plus jeune de cancer du sein, un examen clinique 2 fois/an et une mammographie + une échographie annuelles. Mastectomie prophylactique L’Expertise collective se base sur le risque cumulé sur la vie de cancer du sein (et non une probabilité de mutation comme c’était le cas pour la surveillance clinico-radiologique) et fixe un seuil à 20 % au-delà duquel elle est « envisageable ». Les modèles à utiliser ne sont pas spécifiés. L’âge, défini à partir de 35 ans, peut être modulé par l’âge au diagnostic de cancer du sein chez les apparentés. La mastectomie prophylactique n’apparaît pas dans les recommandations de Saint-Paul concernant les femmes sans mutation détectée. Risque de cancer de l’ovaire Chez les femmes à risque sans mutation identifiée, selon l’Expertise collective, l’annexectomie prophylactique est « envisageable » en cas de risque cumulé de cancer de l’ovaire supérieur à 2-3 %. Les modèles à utiliser ne sont pas précisés, ni l’âge de réalisation. Selon les recommandations de Saint- Paul, l’annexectomie prophylactique est « envisageable » si l’histoire familiale comporte des cas de cancer ovarien ou si la probabilité de détection d’une mutation BRCA1 est « très élevée », sans définition chiffrée d’un seuil de probabilité. L’âge reste à définir, peut-être à partir de 40 ans. En France, la chimioprévention n’a pas d’indication chez les femmes porteuses de mutation BRCA1 et BRCA2 et donc a fortiori chez les femmes à risque sans mutation détectée. Recommandations à l’étranger Pour comparaison, à l’étranger, les seuils de risque de cancer du sein à partir desquels sont établies les recommandations de prise en charge d’une femme sans mutation identifiée sont divers. Aux États-Unis, les recommandations de la Société américaine de cancérologie pour la surveillance mammaire sont basées sur un risque cumulé sur la vie avec un seuil à 20 %(8- 9). Au-delà de ce seuil, une IRM annuelle à partir de 30 ans est recommandée. Au Royaume-Uni, les recommandations du NICE (National Institute for Health and Clinical Excellence) reposent sur deux paramètres : le risque calculé à 10 ans et l’âge, trois niveaux de risque à 10 ans avec des seuils à 3 et 8 % et quatre tranches d’âge (20-29 ans, 30-39 ans, 40-49 ans et au-delà de 50 ans) étant définis(10). Une IRM annuelle est recommandée aux femmes ayant un risque élevé, le seuil étant différent selon l’âge : pour la tranche 20- 29 ans quand le risque à 10 ans est supérieur à 10 %, pour la tranche 30-39 ans quand il est supérieur à 8 % et pour la tranche 40-49 ans, quand il est supérieur à 20 % ou à 12 % en cas de seins denses. Au-delà de 50 ans, l’IRM n’est pas indiquée quel que soit le niveau de risque. En ce qui concerne les indications de mastectomie prophylactique, la Société américaine de chirurgie oncologique stipule qu’il existe une indication « potentielle » de mastectomie prophylactique en cas d’histoire familiale forte (c’està- dire plusieurs apparentés au premier degré et/ou plusieurs générations atteints de cancer du sein) sans que soit précisé de niveau de risque de cancer du sein(11).
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :