Publié le 07 sep 2010Lecture 12 min
Biologie des cancers du sein. Rôle des polluants de l’environnement
R. BAROUKI, INSERM UMR-S 747, Université Paris Descartes, Hôpital Necker-Enfants malades, Paris
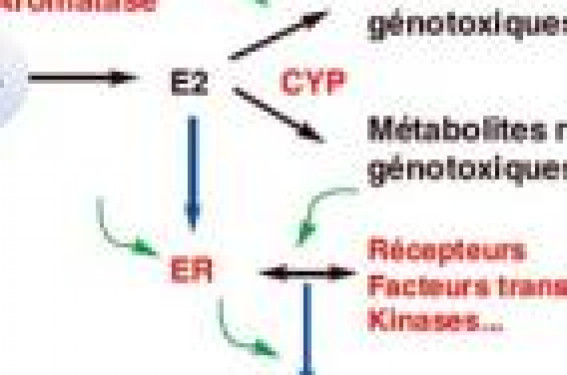
Au cours de ces dernières années, de nombreuses études ont montré que des composés chimiques, dont certains sont des médicaments ou des polluants de l’environnement, mais aussi des composés naturels présents dans les plantes, ont la capacité de mimer ou de moduler les effets des hormones. Ces travaux ont surtout concerné les hormones stéroïdes, principalement les estrogènes et les androgènes, mais l’interaction xénobiotiques-systèmes endocriniens concerne aussi d’autres hormones comme les hormones thyroïdiennes et l’insuline.
Les effets sur les fonctions des hormones thyroïdiennes sont intéressants dans la mesure où la perturbation de cet axe pourrait rendre compte des effets de certains polluants sur le métabolisme et le développement cognitif des enfants contaminés. De même, l’interférence avec les voies de signalisation insulinique revêt un intérêt particulier au moment où l’on constate une véritable épidémie d’obésité et de pathologies métaboliques. Dans ce texte, nous nous focaliserons sur les effets de certains xénobiotiques à activité « estrogénique » (désignés xéno-estrogènes), notamment sur la prolifération des cellules mammaires. Mais il ne faut pas négliger le rôle possible de la perturbation d’autres voies de signalisation comme celle de l’insuline sur le tissu mammaire. Problématiques des xéno-estrogènes Étant donné les effets connus des estrogènes sur le système reproducteur et la prolifération cellulaire, l’attention des chercheurs a été focalisée sur les conséquences possibles de l'accumulation de polluants ou de résidus de médicaments sur la physiologie hormonale et sur les pathologies hormonodépendantes. Certaines études épidémiologiques ont montré une diminution de la fonction reproductrice mâle et une augmentation du nombre de cancers du testicule et du sein au cours des dernières décennies (1). La coïncidence de ces évolutions et de la découverte des effets xénoestrogéniques des polluants a poussé plusieurs chercheurs à émettre l’hypothèse d’une relation de cause à effet. D’autres chercheurs, dont B. Ames, critiquent vivement cette hypothèse et accordent peu de crédit aux conséquences toxicologiques de la pollution par des composés à activité xénohormonale (2). Ces auteurs relèvent l’absence de corrélation entre les concentrations auxquelles un effet xénohormonal est observé et celles qui sont effectivement détectées in vivo. Cette controverse n’est toujours pas totalement éclaircie, mais des travaux récents ont éclairci les mécanismes d’action des polluants de l’environnement et ont suggéré que leurs effets toxiques concernaient plus particulièrement des populations vulnérables. Mécanismes proposés Divers mécanismes ont été proposés pour expliquer les effets des polluants sur la reproduction et la carcinogenèse. Le mode d'action le plus fréquemment proposé est l’activité xéno-estrogénique, à savoir les capacités de ces composés de mimer les effets de l’estradiol. Nous discuterons aussi d’autres mécanismes possibles. La découverte des effets secondaires du traitement par le DES (diéthylstilbestrol) constitue la première mise en cause d'un xénobiotique pour un effet de type hormonal, en l'occurrence estrogénique. Ce composé, utilisé il y a quelques dizaines d'années pour prévenir les risques d’avortement, s'est révélé toxique pour le foetus, puisqu’il a induit l’apparition de cancers génitaux et de malformations génitales chez les filles des mères ayant reçu ce traitement. Activation du récepteur de l’estradiol Le mécanisme principal (mais pas unique) d’un effet xéno-estrogénique est l’activation du récepteur de l’estradiol. Le récepteur des estrogènes (RE) appartient à la famille des récepteurs nucléaires ; son ligand naturel est le 17-β estradiol. Quand l'hormone interagit avec son récepteur spécifique, ce dernier change de conformation, se libère des protéines chaperonnes, puis se dimérise. Le complexe hormonerécepteur dimérique se lie à une séquence d’ADN spécifique appelée ERE (élément de réponse à l'estradiol), localisée dans un promoteur cible. Les pesticides organochlorés (Endosulfan, Toxaphène, o,p'DDT, Dieldrine...) interagissent directement avec le RE et déplacent le 17-β estradiol de son récepteur. Le complexe pesticide- RE peut donc transactiver des promoteurs contenant des ERE, et donc activer de façon illégitime des gènes sensibles à l'estradiol. Ces effets sont souvent observés à forte concentration et sont habituellement partiels. Par ailleurs, certains pesticides ont aussi un effet antagoniste. En réalité, on comprend mieux le mécanisme d’action des pesticides et d’autres perturbateurs endocriniens si on les compare à celui des d’agents pharmacologiques appelés SERM (selective estrogen receptor modulator) comme le tamoxifène : ces agents se comportent comme des agonistes partiels et expriment leur effets pro-estrogéniques dans certaines situations et antiestrogéniques dans d’autres. La perturbation endocrinienne ne se résume pas à un mimétisme hormonal simple. Par ailleurs, le caractère persistant dans l’organisme de certains polluants les distingue de l’hormone naturelle et de certains mimétiques d’origine végétale. Des effets différents selon le récepteur RE Une nouvelle étape dans la compréhension des effets de l’estradiol a été franchie avec le clonage d'un deuxième récepteur à l’estradiol, le REβ (3). Ce récepteur est homologue au récepteur REβ, mais sa répartition tissulaire est différente. Il a été montré que certains « antiestrogènes » ont des effets agonistes ou antagonistes suivant qu'ils interagissent avec le REα ou REβ. Mécanismes de perturbation endocrinienne. Le cas de lʼestradiol est examiné. Les xénobiotiques peuvent affecter soit le métabolisme de lʼestradiol (E2), soit son action. Certains affectent la synthèse de lʼhormone en induisant lʼexpression de lʼaromatase ou son métabolisme en régulant lʼexpression des cytochromes P450 qui transforment E2 en composés plus ou moins toxiques. Dʼautres activent ou modulent le récepteur de lʼestradiol (ER), son interaction avec différentes protéines ou enzymes régulatrices ou la voie de signalisation déclenchée par ce récepteur. Dʼautres niveaux de perturbation sont possibles, notamment le transport plasmatique dans le cas des hormones thyroïdiennes (non montré ici). Ainsi, l’interaction des xénohormones avec l’un ou l’autre de ces récepteurs pourrait avoir des effets très divers sur les organes suivant la distribution de ces deux récepteurs. D’autres mécanismes d’activité xénohormonale ont été rapportés (figure ci-contre). Induction de l’aromatase Des polluants de l’environnement sont susceptibles d’induire l’aromatase et de modifier le métabolisme de l’estradiol. En effet, de nombreux pesticides organochlorés induisent de manière différentielle certains cytochromes P450, enzymes impliquées dans le métabolisme de l’estradiol. Or, certains métabolites de cette hormone ont une activité génotoxique reconnue qui pourrait jouer un rôle dans la cancérisation mammaire. Nous avons montré, il y a quelques années, que la combinaison de pesticides et de dioxine modifie le profil des cytochromes P450 dans les cellules mammaires et pourrait favoriser l’apparition de métabolites génotoxiques (4,5). Effet antiandrogénique Certains composés comme le o,p'DDT, son métabolite le p,p'DDE ou la vinclozoline ont un effet antiandrogénique (6). Ils se lient au récepteur des androgènes et bloquent sa fonction de manière similaire à celle d'un antagoniste comme l'acétate de cyprotérone. L’exposition à ces composés durant la puberté ou l’âge adulte pourrait entraîner des perturbations dans l’apparition du caractère sexuel mâle. Le rôle particulier de la dioxine Elle exerce l’essentiel de ses effets par l’intermédiaire d’un récepteur propre appelé AhR. Or, ce récepteur interagit avec le récepteur de l’estradiol et pourrait soit l’activer soit l’inhiber, selon les modèles expérimentaux (7). Ceci explique la confusion sur le statut anti- ou pro-estrogénique de la dioxine. Des travaux récents indiquent que le récepteur de la dioxine activé était capable de se lier au récepteur REα même en l’absence d’hormone, et d’induire ainsi les gènes sensibles à l’estradiol (8). Par ailleurs, le récepteur de la dioxine provoque aussi la dégradation du récepteur REα en le ciblant vers le protéasome (9). Ces mécanismes complexes pourraient aussi rendre compte de résultats contradictoires concernant le tabac qui contient de nombreux composés de type dioxine. Des travaux récents sur la dioxine suggèrent que ce polluant pourrait avoir un effet sur la progression cancéreuse. En effet, la dioxine active la migration cellulaire et la transition épithélio-mésenchymateuse qui sont nécessaires à la formation de métastases (10,11). À ce stade, ce mécanisme n’a été identifié qu’in vitro et des travaux supplémentaires sont nécessaire pour le valider dans un modèle de cancérogenèse et de progression cancéreuse. Le cas du bisphénol A Ce composé est libéré à partir de matières plastiques et se retrouve dans les aliments, notamment dans le lait. Des travaux récents indiquent qu’à faible dose, ce composé altère chez le rongeur le développement de la glande mammaire, entraînant ainsi des réarrangements tissulaires favorisant la cancérogenèse (12). Ces travaux mettent en lumière deux notions importantes : d’une part, une altération très précoce du développement tissulaire peut se traduire des années plus tard par une augmentation du risque cancéreux, d’autre part, outre la dose, le moment de l’exposition à un toxique est un paramètre fondamental, surtout s’il s’agit d’une situation de vulnérabilité telle que la période foetale et la petite enfance. Enfin, des chercheurs ont aussi suggéré, grâce à des travaux sur les antiandrogènes chez le rongeur, que certains effets des polluants pouvaient être transmis aux générations suivantes (13). Ces effets transgénérationnels sont cependant controversés. Incidence sur le cancer du sein Les lignées de tumeurs mammaires MCF-7 et T47D, sensibles à l’estradiol, prolifèrent en présence des xénohormones. Ceci pourrait avoir une incidence importante sur les cancers mammaires et utérins, dont certains sont hormono-dépendants. Cependant, les premières études épidémiologiques ont été négatives. Ainsi, une étude menée par Hunter et coll. n'a pas montré de corrélation entre une exposition prolongée au DDT et une augmentation de l’incidence des cancers du sein (14). Cette étude est controversée car d’autres auteurs ont montré que, si les composés organochlorés sont présents à faibles doses dans le sang, ils sont 250 à 1 000 fois plus concentrés au niveau du tissu adipeux du sein. Ces composés peuvent être libérés du tissu adipeux causant ainsi de fortes concentrations locales entraînant une activité biologique importante. Par ailleurs, le régime alimentaire peut influer sur le risque de cancer du sein causé par les pesticides. En effet, l’ingestion d’aliments contenant des isoflavonoïdes (graines de soja) ou de la curcumine (épices) a un effet inhibiteur sur l’activité estrogénique des pesticides (15). Ainsi, des femmes exposées à de fortes doses de DDT peuvent présenter des risques différents de cancers du sein en fonction de leurs habitudes alimentaires. Plusieurs revues récentes résument l’état des connaissances sur l’effet de l’environnement sur le cancer du sein (16-18). Ces revues présentent des arguments en faveur d’un lien, mais uniquement dans certaines conditions d’exposition et sur certains terrains génétiques. Ainsi, certains pesticides semblent favoriser le développement d’un cancer mammaire lorsque l’exposition a eu lieu avant la puberté. De même, la relation entre certains PCB et le cancer du sein n’est mise en évidence qu’en présence de certains polymorphismes génétiques d’enzymes du métabolisme des xénobiotiques. L’interaction entre l’environnement, l’équipement génétique et la période d’exposition jouerait un rôle important dans la survenue de ces cancers. Il existe bien des terrains de vulnérabilité (génétique, période du développement) favorisant les effets de certains polluants sur la cancérogenèse mammaire. Ces nouvelles données méritent d’être confirmées par de nouveaux travaux ; elles expliquent pourquoi les premières études, beaucoup plus générales, ont été négatives. Sur la difficulté de conclure ● Malgré la quantité de données biologiques suggérant un rôle possible des polluants xénoestrogéniques dans le cancer mammaire, les études épidémiologiques ne sont pas aussi claires et n’ont pas permis de conclure dans un premier temps. Il est possible que les concentrations de ces composés chez la femme ne soient pas suffisantes pour déclencher un effet hormonal, sauf à certaines périodes du développement ou sur certains terrains génétiques. Par ailleurs, le dosage de ces composés se fait des dizaines d’années après la manifestation de leurs effets toxiques. Bien qu’ils soient très stables dans l’organisme, leur taux au moment du dosage est sans doute un mauvais reflet de leurs concentrations 20 ou 30 ans plus tôt. ● Par ailleurs, beaucoup de ces composés présentent un effet anti- ou pro-estrogénique selon les modalités expérimentales. Leur effet final serait la résultante de mécanismes contradictoires. Le cas de la dioxine est à ce titre éloquent. Il ne faut pas oublier que ces composés toxiques pourraient avoir des mécanismes d’action multiples qui ne sont pas nécessairement en rapport avec leurs effets xénohormonaux, et à nouveau, l’effet final résulterait de la combinaison de l’ensemble de ces mécanismes. ● Enfin, il existe de nombreux facteurs confondants comme la contamination par d’autres polluants ; par exemple, il est apparu récemment que des métaux lourds comme le cadmium ont un effet xéno-estrogénique (19). Les effets des polluants pourraient être modifiés par l’alimentation, la consommation d’alcool, la prise de médicaments, la perturbation du cycle nycthéméral et le profil génétique de l’individu. Ainsi, malgré de fortes suspicions sur le rôle des polluants de l’environnement dans le cancer mammaire, il est difficile à ce jour de donner une conclusion simple concernant la population générale. En revanche, les arguments en faveur d’un risque augmenté sont plus solides pour certaines populations particulièrement vulnérables.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :





