Publié le 16 juin 2013Lecture 7 min
Bilan d’extension d’un cancer ovarien
S. TAÏEB, N. ROCOURT, F. NARDUCCI, A. CHEVALIER, P. NICKERS, E. LEBLANC, L. CEUGNART, Centre Oscar Lambret, Lille
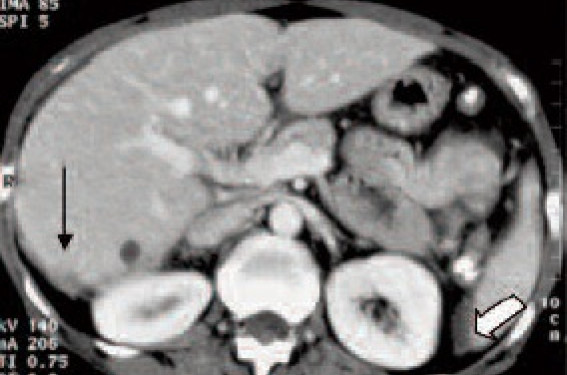
Le thérapeute attend du bilan les informations liées au pronostic de ces cancers accessibles à l’imagerie. Le compte-rendu doit être systématisé selon les différents étages de l’abdomen : sus-mésocolique, sous-mésocolique et pelvien en insistant sur les localisations d’accès difficile à la coelioscopie, et permettant une évaluation de l’opérabilité : région rétrohépatique, rétro-splénique, arrière-cavité des épiploons, aires ganglionnaires lomboaortiques, plancher et parois pelviennes.
La Haute Autorité de Santé (HAS) a publié en 2010, dans le cadre de la mesure 18 du plan cancer 2009-2013, des guides pour les cancers de l’ovaire, les cancers du col utérin et les cancers de l’endomètre. Ces guides ont été élaborés sous le contrôle de l’Institut National du CAncer (INCA) selon la méthodologie de la HAS : analyse exhaustive de la littérature depuis la fin des années 90 jusqu’en 2010, classification des articles selon le niveau de preuves par des groupes d’experts impliqués dans la rédaction initiale et relecture avant diffusion par un second groupe d’experts. Ces guides sont accessibles sur les sites internet des 2 structures (HAS : www.has-sante.fr et INCA : www.e-cancer.fr). L’imagerie est l’un des éléments du bilan préthérapeutique et le compte-rendu du bilan d’extension en imagerie d’un cancer gynécologique doit donner au thérapeute les éléments indispensables à la prise en charge thérapeutique. La structuration des comptes - rendus est basée sur la connaissance des éléments nécessaires à cette prise en charge. Le traitement sera adapté selon la stadification lésionnelle formalisée en cancérologie gynécologique par la Fédération Internationale des Gynécologues et Obstétriciens (FIGO)(1). Le cancer de l’ovaire(2) est la 7e cause de cancer chez la femme en incidence avec 4 430 nouveaux cas estimés en 2008. L’âge médian lors du diagnostic est de 65 ans. Le cancer de l’ovaire est la quatrième cause de décès par cancer chez la femme avec plus de 3 000 décès estimés en 2008. En effet, en raison d’un diagnostic souvent tardif, son pronostic reste sombre, trois quarts de ces cancers étant diagnostiqués à un stade avancé (stades IIIB à IV). La survie à 5 ans tous stades confondus est d’environ 45 %. Le facteur de risque le plus important de cancer de l’ovaire est d’origine génétique. Environ 10 % des cancers de l’ovaire surviennent dans un contexte de prédisposition génétique. Ils sont alors souvent liés à une mutation des gènes BRCA 1 ou 2 et surviennent avant 60 ans. Les types histologiques des lésions ovariennes organiques sont représentés par : les tumeurs épithéliales (85 %), les tumeurs germinales 8 à 15 %, les tumeurs mésenchymateuses 5 %. Les lésions ovariennes organiques sont bénignes dans 75 % des cas. Les lésions malignes sont épithéliales dans plus de 95 % des cas. Le bilan diagnostique commence toujours par une échographie abdomino-pelvienne avec voie endovaginale et étude Doppler. • Soit la lésion présente des caractéristiques évidentes de malignité (ascite avec implants de carcinose), et l’examen à faire est alors un scanner (thoraco)- abdomino-pelvien avec reconstruction dans des plans coronal et sagittal qui est l’examen le plus performant pour le bilan d’extension. Les implants tumoraux des lésions de carcinose péritonéale peuvent être de taille variable et sont disséminés à toute la cavité péritonéale du diaphragme au pelvis. • Soit le diagnostic n’est pas évident en échographie (masse indéterminée ou complexe), et l’examen à réaliser alors a pour but de caractériser la tumeur. Dans ce cas, l’IRM lombo-pelvienne est l’examen le plus performant pour évaluer la nature bénigne, borderline ou maligne d’une lésion afin d’orienter les patientes dans une structure adaptée. La dissémination des cancers ovariens Elle se fait par 2 voies principales(3) : – par infiltration directe aux organes adjacents : utérus, recto-sigmoïde, grêle et plus rarement la vessie ; – par voie péritonéale en suivant la cinétique de circulation du liquide intrapéritonéal. Les 2 autres voies de dissémination tumorale sont : – la voie lymphatique avec 3 voies de drainage : lomboaortique, ilio-obturatrice et inguinale. Cette extension lymphatique peut se faire de façon bilatérale aussi fréquemment au niveau pelvien qu’au niveau lombo-aortique ; – la voie hématogène avec tardivement dans l’évolution la survenue de localisations métastatiques hépatiques, pulmonaires et cérébrales. Le pronostic de la maladie et le traitement dépendent des localisations et de l’étendue de la carcinose péritonéale (tableau). Objectif du bilan d’extension préthérapeutique Il cherche à préciser la topographie et l’importance de la dissémination extra-ovarienne afin d’évaluer si une chirurgie de réduction maximale est envisageable. La recherche de critères de non-résécabilité chirurgicale apparaît ici comme déterminante dans le choix de la stratégie thérapeutique ultérieure. Figure. Femme de 48 ans. Lésions ovariennes bilatérales avec carcinose péritonéale et ascite en échographie. Présentation de 3 niveaux de coupe en tomodensitométrie après opacification digestive et vasculaire. Bien que l’approche chirurgicale à visée de réduction tumorale maximale première soit largement à privilégier, la présence de tels indices peut conduire à opter pour une chimiothérapie néoadjuvante avec chirurgie d’intervalle. En effet, la taille des lésions résiduelles après une chirurgie de réduction maximale est un facteur primordial et indépendant du pronostic. Les lésions sont dites réséquées de manière optimale s’il n’existe plus de lésions visibles en fin d’intervention. La présence de métastases à distance (poumon, foie), d’implants volumineux sur les coupoles diaphragmatiques, surtout s’ils sont proches du confluent cavo-sus-hépatique, de localisations péritonéales au niveau du pédicule hépatique et de la racine du mésentère, de ganglions para-aortiques suprarénaux, de masses volumineuses dans le mésentère imposant des résections digestives majeures, rendent impossible ou déraisonnable une chirurgie optimale et orientent vers une chimiothérapie première. Technique de réalisation du scanner Dans notre institution, l’acquisition des coupes se fait avec une collimation à 0,6 mm tous les 0,5 mm (Somatom definition AS 128 barettes-Siemens medical solution). Les coupes sont ensuite reconstruites en 2 à 5 mm d’épaisseur dans les 3 plans de l’espace : axial, coronal et sagittal. Cet examen est réalisé après balisage digestif par du produit de contraste très dilué (1 litre la veille de l’examen, ½ litre une heure avant, ¼ de litre immédiatement avant) et après opacification vasculaire (100 cc de produit de contraste iodé à 2-3 cm3 par seconde) sans injection à l’étage hépatique puis au temps portal à l’étage hépatique et mixte artérioveineux à l’étage pelvien. La sensibilité du scanner pour la détection des lésions a montré ses limites qui dépendent non seulement de la taille et de la localisation des lésions, mais aussi des paramètres techniques d’acquisition des coupes Ainsi, la sensibilité du scanner quant à la détection des lésions qui est évaluée entre 85 et 93 % en acquisition volumique multibarette, varie de 63 à 79 % en acquisition monocoupe. Cependant, même en acquisition volumique, la sensibilité ne dépasse pas 50 % pour les lésions de moins de 1 cm de l’étage susmésocolique ; elle est même inférieure à 50 % en l’absence d’ascite. L’apport du PET TDM, et dans cette indication, est en cours d’évaluation. Le compte-rendu Il doit être systématisé selon les différents étages de l’abdomen (figures)(4) : susmésocolique, sous-mésocolique et pelvien en insistant sur les localisations d’accès difficiles à la coelioscopie d’évaluation de l’opérabilité : région rétro-hépatique, rétro-splénique, arrière cavité des épiploons, aires ganglionnaires lomboaortiques, plancher et parois pelviennes. La relecture conjointe des images avec le chirurgien permettra d’anticiper les difficultés opératoires prévisibles, la nécessité et le nombre de résections digestives et la morbidité postopératoire qui pourrait retarder la chimiothérapie. En effet, il s’agit d’orienter au mieux les patientes, soit vers une chirurgie première dont l’objectif est d’être R1 (pas de lésions macroscopiquement visibles au décours de l’intervention), soit vers une chimiothérapie première suivie d’une chirurgie intervallaire à 3 cures de chimiothérapie, après une nouvelle évaluation clinique, biologique (Ca125) et radiologique.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :





