Obstétrique
Publié le 05 juin 2020Lecture 9 min
Prise en charge de l’allo-immunisation érythrocytaire fœto-maternelle
E. MAISONNEUVE, Service de médecine fœtale et Centre national de référence d’hémobiologie périnatale, Pôle de périnatalité, hôpital Armand Trousseau, Paris
Les allo-immunisations fœto-maternelles anti-d (RH1 en nomenclature internationale), anti-Kell (KEL1) et anti-c (RH4) sont responsables de maladies hémolytiques du fœtus et du nouveau-né (MHFn) sévères. Le succès de la prise en charge des grossesses compliquées d’allo-immunisation érythrocytaire repose d’une part sur le diagnostic d’incompatibilité fœto-maternelle grâce au génotypage fœtal non invasif, et d’autre part sur la détection précoce des anémies fœtales modérées à sévères grâce à l’échographie doppler. La transfusion fœtale intravasculaire a complètement transformé le pronostic de cette pathologie, permettant d’éviter de nombreux décès in utero ainsi que les conséquences de la grande prématurité. La prévention de l’allo-immunisation anti-d ne sera pas traitée dans cet article.
Physiopathologie
L’allo-immunisation est la réponse immunitaire de l’organisme au contact d’antigènes érythrocytaires étrangers. Les trois situations à risque d’allo-immunisation sont : les grossesses, lestransfusionssanguines et les greffes d’organes.
La prévalence de l’allo-immunisation érythrocytaire fœtomaternelle en France est de 0,5 à 1 % des grossesses(1). Lors d’une grossesse, dans certaines situations sensibilisantes, des hématies fœtales peuvent passer dans la circulation maternelle. Si une femme enceinte ne possède pas un antigène érythrocytaire donné et que le fœtus l’a hérité de son père biologique, le premier contact entre le sérum maternel et l’antigène des globules rouges fœtaux va entraîner la production d’allo-anticorps de type IgM par le système immunitaire maternel. Les IgM ne traversant pas la barrière placentaire, l’allo-immunisation n’aura donc habituellement pas de conséquence pour cette première grossesse. Un deuxième contact entre le sérum maternel et l’antigène fœtal, survenant le plus souvent lors des grossesses suivantes, va entraîner une réponse immunitaire secondaire : une production massive et rapide d’IgM et d’IgG. Les IgG vont traverser le placenta et se diriger contre les hématies fœtales entraînant une hémolyse(2).
Les situations à risque d’hémorragie fœto-maternelle augmentent le risque d’allo-immunisation,mais il existe également un passage spontané d’hématies fœtales dont l’importance augmente avec l’âge gestationnel (5,5 % et 7 % d’hémorragies fœtomaternelles asymptomatiques dépistées par test de Kleihaeur à 29 et 34 SA respectivement)(3). Ce risque de passage est le plus important au moment de l’accouchement(2).
L’allo-immunisation peut entraîner de graves conséquences fœtales et néonatales. L’hémolyse fœtale entraîne une anémie. Pour pallier cette anémie, une érythropoïèse compensatrice se produit, entraînant une hépatomégalie, à l’origine d’une souffrance hépatocytaire fœtale (par compression des hépatocytes et des vaisseaux hépatiques). Cette souffrance hépatique entraîne une diminution de la synthèse des protéines hépatiques, dont l’albumine, à l’origine d’une diminution de la pression oncotique. Si l’anémie n’est pas corrigée par une transfusion in utero, l’activité myocardique va augmenter, entraînant une défaillance cardiaque puis un état d’anasarque fœtale (ascite, épanchement péricardique, œdème sous-cutané, hydramnios...) et peut conduire à la mort fœtale in utero (MFIU) (2,4). Durant la grossesse, la bilirubine libérée lors de l’hémolyse est éliminée parle foie maternel. à la naissance, le foie du nouveau-né est immature et la bilirubine libre n’est pas conjuguée correctement. Il existe donc un risque d’ictère nucléaire.Deplus, laprésenced’anticorpsmaternels persistants dans sa circulation peut nécessiter la réalisation d’une exsanguino-transfusion pour limiter l’hémolyse néonatale(5).
Épidémiologie
L’allo-immunisation anti-D (RH1) est devenue rare depuisla généralisation de la prophylaxie par immunoglobulines anti-D au cours des années 1970. Elle reste pourtant de loin la première cause d’anémie fœtale(6). Les autresimmunisations pouvant être fréquemment à l’origine d’une anémie fœtale sont, par ordre de fréquence décroissante : anti-Kell (K1), anti-c (RH4) et exceptionnellement anti-E (RH3) et anti-M (MNS1) (tableau). Enfin, de nombreuses autres immunisations peuvent provoquer des MHFN mais de manière beaucoup plus rare(5-7).
Prise en charge des grossesses avec allo-immunisation érythrocytaire
Le génotypage non invasif du Rhésus fœtal
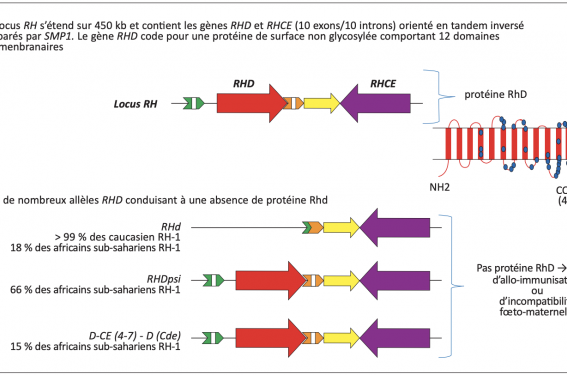
Afin d’étudier l’ADN fœtal libre et déterminer le Rhésus du fœtus, il faut amplifier par PCR le gène RHD, car l’antigène D est codé par le gène RHD. Pour le génotypage du Rhésus fœtal, la technique utilisée est la PCR en temps réel, avec une détermination fiable dès 11 SA(8). Afin de prévenir le risque de faux négatifs, chaque génotypage Rhésus revenant négatif est recontrôlé. Le kit Jacques Boy® première génération amplifie les exons 7 et 10 du gène RHD. Il est applicable dans le population caucasienne, chez qui la présence des exons 7 et 10 est retrouvée chez 99 % des sujets RH:1 (D positif). Ainsi, chez les sujets RH:-1 (D négatif), les exons 7 et 10 seront absents dans le cas d’une délétion complète du gène RHD. Cependant, il existe des cas particuliers qui doivent être connus pour interpréter le génotypage Rhésus D fœtal (figure 1). En effet, il existe selon l’origine ethnique des variations génétiques(9) :
– dans la population caucasienne, 15 % des individus sont de phénotype RH:-1. Chez 9 % de ces sujets, ce phénotype est dû à une délétion du gène RHD ;
– dans la population africaine, la fréquence de sujets RH:-1 est de 5 %. On observe une délétion du gène D dans 18 % des cas. Dans 66 % des cas, il existe un gène D y ou « pseudogène », dans lequel l’ajout de 37 paires de bases induit l’apparition d’un codon stop empêchant la traduction du gène en protéine. Il n’y a donc pas d’antigène D à la surface des hématies.
Le génotypage fœtal Kell (KEL1) est utilisé dès 13 SA pour les patientes allo-immunisées anti-Kell afin de déterminers’il existe une incompatibilité fœto-maternelle (fœtus Kell+).
Les génotypages fœtaux c (RH4) et E (RH3) sont égalementréalisés au CNRHP à partir de 13 SA(10). La surveillance ne s’impose que lorsque le génotypage fœtal est positif, correspondant à une incompatibilité fœto-maternelle. Elle peut être interrompue lorsque le génotype fœtal est négatif, confirmé sur un 2e prélèvement.
Figure 1. Base moléculaire du génotypage RHD, A. Mailloux, CNRHP biologique(9).
Dosage pondéral et titrage des anticorps
Le risque d’anémie fœtale peut pratiquement être considéré comme nul lorsque le dosage pondéral de l’anticorps reste inférieur à 1 μg/mL (correspond à 250 UCHP/mL) ou lorsque le titrage est inférieur à 1/16(11, 12). Certains anticorps, comme les anti-Kell, ne peuvent être dosés et l’évaluation du risque ne repose alors que sur le titrage. On considère qu’un titre ≥ 1/16 est à risque d’anémie fœtale(5). La surveillance fœtale recommandée en cas d’alloimmunisation maternelle est résumée sur la figure 2 et sur le tableau.
Figure 2. Schéma de prise en charge d’une patiente ayant une allo-immunisation anti-D.
Diagnostic de l’anémie fœtale par échographie-doppler de l’artère cérébrale moyenne
Le diagnostic de l’anémie fœtale a été révolutionné par la mesure du pic systolique de vélocité de l’artère cérébrale moyenne (PSVACM) (figure 3)(13). Dans le contexte d’une allo-immunisation érythrocytaire à risque d’anémie fœtale, cette mesure doit être réalisée systématiquement de manière hebdomadaire. Les autres signes d’anémie fœtale reposent sur les signes échographiques d’anasarque. L’existence d’une anasarque franche est le signe d’une anémie < 5-6 g/dL et évoluant depuis un certain temps. La mesure du PSV-ACM permet d’identifier de manière fiable l’anémie, bien avant la constitution d’une anasarque (sensibilité = 100 %, spécificité = 78 % )(13). En revanche, le tracé cardiaque fœtalsinusoïdal est un signe tardif et peu spécifique.
Figure 3. Doppler de l’artère cérébrale moyenne.
Traitement de l’anémie fœtale : les transfusions in utero (TIU)
La TIU estréalisée en salle d’échographie interventionnelle ou préférentiellement au bloc opératoire lorsque l’âge gestationnel permet d’envisager une extraction fœtale en cas de complication peropératoire.
Le sang devra être soigneusement sélectionné afin d’assurer la compatibilité avec le sang maternel et fœtal. Il sera nécessairement O RhD-négatif et compatible avec le phénotype sanguin maternel (Kell, Jka…) afin d’éviter l’apparition de nouvelles immunisations qui rendraient délicate la sélection de culots pour les transfusions ultérieures. Le sang est déleucocyté, déplasmatisé et irradié. Enfin, le culot est concentré pour obtenir un hématocrite de plus de 70 % afin de limiter le volume à transfuser(14,15).
Le premier temps consiste en une ponction de sang fœtal dans la veine ombilicale et la mesure du taux d’hémoglobine fœtale par un analyseur extemporané type Hemocue®. Les quantités de sang à transfusersont estimées à l’aide d’abaques faisant intervenir le poids fœtal estimé, le taux d’hémoglobine initial, le taux d’hémoglobine cible et l’hématocrite du culot globulaire.
La TIU reste un geste invasif non dénué de risques, même s’il est parfois difficile de distinguer les complications liées à l’acte transfusionnel de celles liées à la gravité de la pathologie sousjacente, notamment en cas d’anasarque. Le taux de morbidité sévère et de pertes fœtales varie de 1,2 % à 2,7 % par procédure selon les auteurs(16). Dans l’éventualité de complications survenant au cours ou au décours de l’intervention, les mesures préventives des complications de la prématurité doivent être mises en œuvre : cure de corticoïdes 48 h avant la TIU, réalisation du geste dans un centre de type 3 avant 32 SA et réalisation du geste au bloc opératoire afin de permettre une césarienne en urgence le cas échéant.
Au-delà de 34 SA, le rapport bénéfices/risques d’une TIU par rapport à une extraction fœtale doit être évalué. L’existence d’une anasarque doit faire surseoir à une extraction immédiate qui rendrait la réanimation néonatale extrêmement difficile et à risque de morbi-mortalité élevé. Il est ainsi préférable de réaliser une TIU, permettant la régression de l’anasarque avant la naissance (ce qui peut prendre deux à trois semaines)(17).
Traitement complémentaire non invasif des allo-immunisations très sévères
En cas d’allo-immunisation érythrocytaire très sévère avec antécédent de perte fœtale à la grossesse précédente, certaines équipestraitent les patientes par immunoglobulines intraveineuses (IgIV) polyvalentes et/ou plasmaphérèses répétées afin de décaler la date de la première transfusion(18, 19). Les immunoglobulines polyvalentes semblent efficaces afin de décaler l’âge gestationnel de la première TIU d’environ 2 semaines, mais il n’existe actuellement que quelques séries et aucune étude randomisée. Le schéma thérapeutique utilisé par le CNRHP est : IgIV 1 g/ kg/semaine à partir de 11 SA et jusqu’à la première TIU. Il n’existe pas de schéma thérapeutique standardisé(20).
Pronostic à long terme de l’anémie fœtale
Les séries prospectives de suivi des enfants nés après TIU rapportent un développement cérébral normal dans environ 95 % des cas. La présence d’une anasarque lors du diagnostic d’anémie est un facteur de risque indépendant de séquelles neurologiques à long terme(21). Quelques rares cas de lésions cérébrales fœtales, probablement anoxiques ont été rapportés(22, 23). Dans les cas observés, il existait à chaque fois une situation d’anémie profonde avec anasarque. Il est donc recommandé de réaliser une IRM cérébrale à 32 SA pour les fœtus dont l’hémoglobine a été inférieure à 5 g/dL et/ou en cas de transfusions fœtales répétées.
Conclusion
Le génotypage fœtal non invasif et le Doppler de l’artère cérébrale moyenne sont des outils essentiels pour la prise en charge des patientes enceintes allo-immunisées. La transfusion in utero est l’une des rares thérapeutiques efficaces, permettant la survie sans séquelles d’enfants dont le pronostic spontané aurait été défavorable. La gravité de la pathologie sous-jacente et le risque de complications iatrogènes doivent néanmoins être prises en compte et incitent à une identification et à une prise en charge les plus précoces possibles. La prise en charge des allo-immunisations érythrocytaires, a fortiori compliquées d’anémie fœtale nécessite une prise en charge multidisciplinaire dans un centre d’expertise impliquant obstétriciens, échographistes, immunohématologues et pédiatres, afin d’améliorer le pronostic de ces grossesses
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :






