Sexologie
Publié le 13 jan 2018Lecture 11 min
À la recherche du « point G » en imagerie IRM : un nouvel outil d’observation de la sexualité féminine
Yvonne K. MARATOS et coll.* - Radiologie de la Croisette, Cannes
Nos travaux ont montré que l’imagerie IRM permet d’individualiser une protrusion de la paroi antéro-inférieure du vagin correspondant aux critères anatomiques et morphologiques du point G, décrits dans des travaux récents sur des cadavres frais. Il s’agit d’un complexe neuro-vasculaire parfaitement identifiable avec un protocole standard sur des machines habituelles (1,5 Tesla), à condition d’effectuer une distension vaginale à l’aide d’un gel d’ultrason. Ce protocole a permis une visualisation de ce « complexe G » dans tous les cas de notre étude. Ces travaux ne permettent pas d’affirmer la fonctionnalité de cette entité anatomique dans la jouissance de la femme, mais apporte un élément supplémentaire au débat et confirme l’intérêt de l’IRM dans l’exploration de l’anatomie et de la sexualité féminine.
Si l’existence potentielle du « point G » constitue encore et toujours une source de débat, il est fascinant de constater que la mention d’une zone érogène située sur la paroi antérieure du vagin remonte à des textes antédiluviens en provenance de Chine ou d’Inde qui décrivent un « fruit laitier » chez Bai Xin Jian dans les « Amusement du paradis et de la terre » ou une zone susceptible de produire une « tempête d’eau d’Amour » dans l’Ananga Ranga, traité hindou de l’amour conjugal. Sous nos latitudes, il faudra attendre le 17esiècle et l’anatomiste néerlandais Regnier de Graaf pour avoir la description d’une zone anatomique érogène distincte dans la paroi vaginale antérieure ; quant au terme « Gräfenberg Spot » ou « G-Spot », celui-ci est inventé aux États-Unis dans les années 80 par Addiego en l’honneur du médecin allemand Ernst Gräfenberg qui a décrit cette même zone dans les années 40 et 50. C’est en 1982 que le point G atteint le statut de mythe moderne. Le best seller de Khan et Whipple a, depuis, alimenté la controverse sur une base régulière caractérisée par une absence de démarche scientifique rigoureuse et de recherche suffisamment précise ou approfondie. Il était donc frappant à nos yeux qu’une question si âprement débattue ne soit pas encore largement étudiée avec l’IRM pelvienne étant donné la qualité des détails obtenus avec cet outil moderne.
Les balbutiements de l’IRM dans l’étude de la sexualité féminine
La revue de la littérature montre que peu d’études employant l’IRM ont été réalisées pour mieux caractériser l’anatomie du plancher féminin en rapport avec la sexualité féminine. Schultz, par exemple, a effectué des images IRM lors du coït afin d’en étudier l’anatomie. Dans son étude, il précise ne pas individualiser de point G. Il décrit cependant un allongement de la paroi antérieure du vagin qui traduit indirectement des événements survenant dans cette région en rapport avec un engorgement vasculaire. Nous y reviendrons lorsque nous évoquerons les études dynamiques effectuées sous échographie. Gutman et coll. ont étudié en IRM les relations anatomiques chez 11 femmes nullipares entre l’apex vaginal, les épines ischio-pubiennes et le sacrum. Ils n’ont pas non plus trouvé de point G ; cependant, l’auteur n’a jamais cherché à visualiser de structure pouvant être corrélée au point G, ni même utilisé ce terme dans son article. Cela montre que les données d’imagerie IRM sur la localisation anatomique présumée du point G sont absentes ou au mieux insuffisantes.
Sortir de la dialectique vaginale vs clitoridienne : apport de l’IRM fonctionnelle
Komisiaruk et coll. ont utilisé l’IRM fonctionnelle pour visualiser les aires cérébrales corticales répondant aux stimulations du vagin, du clitoris, du col et des mamelons. Ces stimulations se sont avérées différenciables et en cohérence avec les innervations des différents nerfs afférents et leurs corollaires comportementaux. L’identification de différentes zones cérébrales en IRM fonctionnelle renforce la théorie selon laquelle il existe des zones érogènes différentes dans le pelvis féminin.
Des études anatomiques à revisiter
Comme l’a exposé O’Connell, il est étonnant de constater que la majorité des descriptions actuelles de l’anatomie urétrale et génitale humaine féminine sont inexactes. Sur la base de ces travaux récents, d’autres recherches complétées par une imagerie IRM ou échographique ont permis de démontrer que le vagin distal et l’urètre sont clairement connectés, formant un noyau médian du clitoris et de suggérer que les bulbes vestibulaires sont intimement liés aux autres composants clitoridiens et forment ce que Jannini et Buisson nomment le complexe clito-urétro-vaginal ou « complexe clitoridien » à proximité des glandes de Skene. Ils suggèrent que ce complexe clitoridien forme un ensemble anatomique cohérent – une vision contestée par les « traditionalistes », comme Puppo, qui s’opposent avec véhémence à ces observations sur la base d’interprétation embryologique. Par ailleurs, signalons que les études histologiques nous enseignent que la paroi antérieure distale du vagin est plus densément innervée renforçant notre intérêt pour cette zone en particulier.
Le point G : un « complexe » organique composé de différentes structures anatomiques
Ostrzenski et coll. ont jeté un pavé dans la mare en affirmant sur la base d’une dissection du vagin « strate par strate » que le point G apparaît comme un complexe neurovasculaire avec un ganglion se situant dans du issu fibroglandulaire et adipeux entouré de nombreux nerfs. L’article a suscité de nombreuses critiques mais l’auteur a complété son observation préliminaire en menant de nouvelles investigations anatomiques sur la présence d’un « complexe G » sur 9, puis 11 cadavres consécutifs. L’auteur a confirmé la présence d’un « complexe neurovasculaire » chez tous les sujets, décrit les caractéristiques histologiques et donné des informations détaillées sur sa localisation et sa distance avec les repères anatomiques environnants (comme le méat urétral). Par ailleurs, et comme le souligne Shu Pan, la structure décrite possède bien les caractéristiques requises d’un organe sensoriel, même si, comme il le souligne, l’anatomie par dissection et des preuves histologiques sont insuffisantes pour démontrer une entité fonctionnelle. Il n’en demeure pas moins que ces éléments constituent une première étape indispensable qu’il convient de vérifier in vivo.
Une étude pilote pour visualiser le « complexe G » in vivo à l’aide de l’IRM
Ces travaux nous ont motivé à effectuer une étude qui a été récemment publiée dans le British Journal of Obstretrics and Gynaecology; son but principal était de voir si les techniques classiques d’imagerie IRM sont capables de localiser cette entité morphologique distincte correspondant au « complexe G » décrit par Ostrzenski et d’élaborer un protocole d’imagerie IRM approprié pour cette tâche. Nous avons donc réalisé une étude observationnelle rétrospective de janvier à mars 2014 d’une série consécutive de 21 patientes âgées de 17 à 72 ans qui ont été examinées par IRM pelvienne avec des protocoles d’imagerie de routine pour des indications médicales habituelles (ménométrorragies, douleurs pelviennes, bilan de cancer du col, etc.).
Une visualisation du « complexe G » par IRM chez toutes les patientes avec opacification du vagin
Une opacification du vagin par du gel d’ultrasons a été réalisée dans 48 % des cas (10/21) de notre étude. Nous avons pu ainsi identifier une entité anatomique distincte correspondant aux critères du complexe G prédéfinis dans la paroi vaginale antérieure chez toutes les femmes ayant bénéficié d’une opacification vaginale (10/10) et dans seulement 3 cas sur 11 sans opacification vaginale (c’était des cas avec un complexe G particulièrement volumineux). Par ailleurs, la taille du complexe G ne dépend pas de l’âge ou du statut hormonal des femmes, puisque des complexes G de tailles importantes (jusqu’à 9 mm en antéro-postérieur) ont été observés chez des patientes âgées et ménopausées. La méthode d’application d’un gel d’ultrason associée à un signal homogène du gel dans la cavité et à la distension résultante de la paroi vaginale, a donc permis un taux de détection plus élevé, statistiquement significatif, du complexe G (p < 0,01) dans le voisinage anatomique décrit par Ostrzenski et coll. par rapport à la technique sans remplissage vaginal.
Le signal IRM du « complexe G »
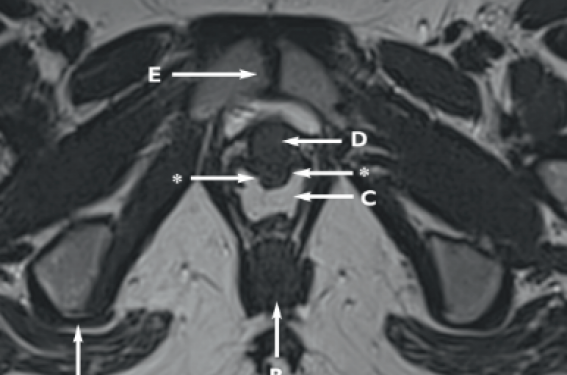
En IRM, les différents issus ont une nuance de gris plus ou moins intense par rapport à leur composition et selon les séquences IRM. Pour simplifier, quand les images sont pondérées en T2, le liquide est blanc, la coricale de l’os est noire et les différents issus ont une nuance de gris selon leur composition chimique et leur contenu en eau. Le complexe G contient des vaisseaux, des nerfs, un ganglion, du issu fibro-conjoncif et de la graisse. Cela suppose que cette formation est en hypersignal relatif (donc un peu plus clair ou moins foncé) que le signal du muscle dans des séquences anatomiques T2. Les figures 1 et 2 illustrent des exemples de complexe G individualisés en IRM.
Figures 1. Patiente nullipare de 28 ans ; examen effectué à la recherche de signes d’endométriose. Absence d’antécédent particulier. Coupe axiale T2 (a) et sagittale (b) après opacification vaginale : visualisation d’une protrusion de signal intermédiaire à la face postérieure de l’urètre. 1a. A. tubérosité sciatique. B. région anale. C. cavité vaginale distendue par du gel d’ultrason. D. urètre. E. symphyse pubienne. Les flèches marquées avec une étoile « * » entourent le complexe G. 1b. A. région anale. B. symphyse pubienne. C. cavité vaginale distendue par du gel d’ultrason. D. vessie. E. utérus. F. vertèbre S1. G. sacrum. Les flèches marquées avec une étoile * entourent le complexe G.
Figure 2. L’importance de la distension vaginale par du gel. 4 images de la même patiente : coupes axiale (a) et sagittale (b) sans, puis avec distension vaginale par gel dans le plan axial (c) et sagittal (d). Ce cas illustre qu’une distension vaginale permet de voir une petite protrusion de la paroi antérieure du vagin chez cette patiente latéralisée à droite par rapport à l’urètre. 2a. Acquisition axiale T2 3D avec des coupes millimétriques sans opacification vaginale. A. tubérosité sciatique. B. région anale. C. urètre. D. pubis. Les flèches marquées avec une étoile « * » entourent le complexe G. 2b. Acquisition sagittale T2 3D avec des coupes millimétriques sans opacification vaginale. A. région anale. B. urètre. C. parois du vagin collabées. D. pubis. E. vessie. F. vertèbre S1. G. ampoule rectale. 2c. Acquisition axiale T2 avec opacification vaginale. A. tubérosité sciatique. B. région anale. C. urètre. D. pubis. Les flèches marquées avec une étoile « * » entourent le complexe G qui est mieux visible compte tenu de l’opacification vaginale. 2d. Acquisition sagittale T2 avec opacification vaginale. A. région anale. B. urètre. Les flèches marquées avec une étoile « * » entourent le complexe G. D. pubis. E. vessie. F. vertèbre S1. G. ampoule rectale.
Des différences entre études in vivo et post-mortem
En comparaison avec les mesures présentées dans l’étude d’Ostrzenski et coll., des différences significatives ont été observées en ce qui concerne la distance entre le méat urétral et le complexe du point G, sa hauteur et son épaisseur. Les dimensions anatomiques significativement plus grandes de notre cohorte s’expliquent par le fait que les chiffres donnés par Ostrzenski se réfèrent à l’entité histologique du point G consistant en du issu nerveux et de son ganglion noyé dans le issu adipeux. Comme ces structures ne peuvent pas être séparées en IRM, nous avons mesuré le complexe en entier, y compris le système vasculaire enchevêtré, ce qui explique des épaisseurs plus importantes. En ce qui concerne la distance moyenne du complexe au méat urétral (23,6 mm contre 45 mm dans Ostrzenski et coll.), la différence peut être expliquée par 2 facteurs : un complexe vasculaire est plus grand in vivo dès lors qu’il est perfusé avec le sang, ce qui diminue sa distance au méat urétral. Une autre raison pourrait être une variation de taille d’un sujet à l’autre.
Des résultats qui viennent compléter les données actuelles
À ce jour et dans la lignée des travaux de O’Connel, plusieurs études échographiques approfondies ont été menées en se concentrant sur la relation dynamique du clitoris, de l’uretère et de la paroi vaginale antérieure, soit lors de la pénétration des doigts ou des rapports sexuels chez les couples volontaires. Ces études ont contribué au concept du « complexe clitoridien » (ou complexe clito-urétro-vaginal) et se différencient de la recherche d’un point G indépendant, en soulignant le rôle de ces structures anatomiques dans une interaction morpho-foncionnelle pouvant induire l’orgasme féminin. Ces équipes ont montré que lorsqu’il est gonflé, les portions internes du clitoris entourent la partie antérieure du mur vaginal. Nous voyons donc notre étude comme une nouvelle pièce du puzzle, et comme un manifeste quant à l’intérêt de l’IRM pour faire avancer nos connaissances anatomiques et fonctionnelles de la région génitale de la femme. De notre point de vue, l’idée d’un point G ou plus précisément d’un « complexe G » en tant qu’entité anatomique distincte n’est pas en contradiction avec les interactions fonctionnelles complexes décrites par les différents auteurs. Comme le suggère notre étude pilote, nos résultats viennent compléter ces données, bien que nous ne soyons pas en mesure de proposer une corrélation morphologique unique chez tous les sujets, ce qui peut être une découverte importante en elle-même.
L’IRM, un outil utile et adapté à l’étude de sexualité féminine
L’étude du « complexe G » ne nécessite pas d’équipement spécial ni de protocoles IRM particuliers. La visibilité de ce « complexe » est significativement améliorée avec la distension vaginale par du gel d’ultrason. D’autres études d’imagerie IRM sont justifiées, associées à des corrélations fonctionnelles afin d’élucider la valeur de l’imagerie non invasive pour le diagnostic, ou peut-être même le traitement des entités pathologiques associées comme la dysfonction sexuelle. Par ailleurs, et sur la base de ces premiers éléments, il nous paraît tout à fait déconseillé d’aller intervenir à l’aveugle sur une structure anatomique dont nous n’avons pas déterminé les aspects fonctionnels. Précisons enfin, et comme l’a souligné Pfaus, que la cartographie du corps érotique de la femme n’est pas gravée dans la pierre ; il s’agit plutôt d’un processus continu d’expérience, de découverte et de construction qui dépend de la capacité de son cerveau à créer l’optimalité entre ce qu’elle attend et une ouverture aux nouvelles expériences.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :






