Publié le 11 jan 2011Lecture 9 min
La réceptivité endométriale : intérêt du l’échographie tridimensionnelle couplée au power Doppler-angio (3D-PDA)
P. VIGNAL
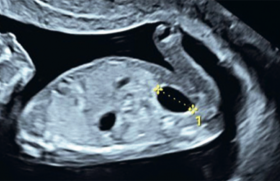
Peu de progrès ont été faits depuis les débuts de la FIV au regard des taux d’implantation au cours des cycles de transfert d’embryons. Aujourd’hui encore, ces taux ne dépassent pas 30 % et se situent plutôt autour de 20 %.
Comme les embryons implantés sont de bonne qualité, ces mauvais résultats sont liés à la réceptivité de l’endomètre. Pour le moment, l’appréciation de cette réceptivité se résume à la mesure de l’épaisseur de l’endomètre et à l’étude de son aspect. Malheureusement, un aspect en triple feuillet et une épaisseur de plus de 9 mm ne garantissent pas l’implantation et, inversement, des grossesses sont obtenues avec un endomètre hyperéchogène peu épais. Par ailleurs, le nombre de grossesses multiples lié à une politique de transfert multi-embryonnaire, n’a pas diminué. De meilleurs critères de réceptivité endométriale permettraient d’encourager une politique de transfert mono-embryonnaire. La prolifération endométriale et la croissance du stroma des glandes dépendent de processus de néovascularisation au lendemain des règles. La qualité de cette régénération vasculaire pourrait conditionner celle de la prolifération cellulaire. L’étude de cette néoangiogenèse peut se faire de façon non invasive depuis peu, grâce aux progrès de l’échographie. Couplé au Doppler puissance, l’échographie 3D permet de faire une véritable angiographie de l’endomètre, ouvrant de nouveaux horizons pour l’étude de la réceptivité endométriale. L’épaisseur de l’endomètre : une donnée toujours clé en PMA La mesure de l’épaisseur de l’endomètre reste toujours une donnée clé en PMA. Sa mesure, en apparence facile, demande en fait une méthodologie rigoureuse pour obtenir une reproductibilité satisfaisante que ce soit pour un même observateur ou des observateurs différents. Figure 1. Mesure de lʼépaisseur de lʼendomètre. L’image de l’utérus en position parfaitement sagittale doit être zoomée d’une façon importante jusqu’à occuper au moins les trois quarts de l’écran, un peu comme pour la mesure de la nuque. De cette façon, le déplacement des marqueurs se fait par dixième de millimètres. La mesure doit se faire toujours au même emplacement. Il est recommandé de mesurer l’épaisseur maximale à l’union du tiers supérieur et des deux tiers inférieurs de l’endomètre sur la coupe sagittale. Dans ces conditions, il est rare d’avoir des variations dépassant un millimètre. L’étude de l’aspect de l’endomètre est uniquement subjective ; on oppose classiquement l’aspect trilaminaire à l’endomètre hyperéchogène (figure 1). L’épaisseur de l’endomètre augmente au cours de la stimulation parallèlement à l’estradiolémie. De même, l’aspect en triple feuillet s’accentue. Néanmoins, dans les cycles avec antagonistes de la LHRH, on peut assister à une diminution de cette épaisseur en dépit de l’ascension de l’estradiolémie. Ces molécules pourraient avoir un effet direct sur l’endomètre sans pour autant diminuer les chances d’une grossesse. La croissance de l’endomètre résulte d’un équilibre entre prolifération cellulaire et apoptose, afin de ne pas dépasser une épaisseur donnée. Il semble que cette épaisseur soit fixée pour chaque patiente ; certaines d’entre elles ne peuvent dépasser 5 ou 6 mm d’épaisseur en dépit d’une augmentation des taux d’estradiol. Avec l’échographie 3D, la mesure du volume est devenue possible. Figure 2. Mesure du volume de lʼendomètre grâce au système VOCAL : rendu volumique. On utilise la technique VOCAL (VOlume CALculation ou Virtual Organ Computer-aided AnaLysis), grâce à laquelle il est possible de dessiner une enveloppe d’un tissu ou d’un organe au sein d’un bloc volumique. Comme prévu, le volume évolue comme l’épaisseur et sa mesure n’apporte aucune information supplémentaire, d’autant qu’une mesure précise implique des rotations de 9°, longues et fastidieuses. Cependant, la mesure du volume permet de mettre en évidence des variations subtiles de croissance inapparente à la simple mesure de l’épaisseur (figure 2). L’angiogenèse : un marqueur de la réceptivité endométriale prometteur La croissance de l’endomètre (glandes et stroma) est soustendue par la création chaque mois d’une néovascularisation, encore appelée néoangiogenèse, qui joue probablement un grand rôle dans la réceptivité endométriale. Ce phénomène est le plus souvent le fait d’un processus pathologique : cancérogenèse, cicatrisation. Le tissu endométrial est physiologiquement le seul à avoir cette capacité d’induire la formation de néovaisseaux à partir de vaisseaux situés dans son voisinage. Cela n’est pas étonnant, car le début du cycle est un véritable processus de cicatrisation Figure 3. Halo sous-endométrial sur une coupe frontale (plan C) en échographie 3D. Cette propriété a été parfaitement mise en évidence dans une expérience de greffe d’endomètre à différents stades du cycle dans la membrane chorioallantoïdienne du poulet. Une augmentation progressive de ce pouvoir d’induction a été constatée jusqu’aux environs du 10e jour, suivie d’une décroissance jusqu’à l’ovulation et d’une réascension pendant la phase lutéale. Endomètre et myomètre sous-endométrial : une unité fonctionnelle La néoangiogenèse trouve son origine dans le myomètre subendométrial. La partie subendométriale du myomètre est rattachée à l’endomètre car ses récepteurs aux estrogènes et à la progestérone varient en fonction du cycle, comme ceux de l’endomètre. Celui-ci est particulièrement bien visible en IRM, et prend alors le nom de zone jonctionnelle. En échographie, il est décrit comme le halo sous-endométrial, visible surtout sur les coupes coronales de l’échographie tridimensionnelle (figure 3). Son épaisseur varie selon les auteurs entre 1 et 10 mm et semble augmenter avec l’âge. Figure 4. Histogramme des voxels avec mesure automatique des index de vascularisations : VI, FI, VFI. La mesure de la néoangiogenèse se fait par une échographie appelée 3DPDA, qui associe le Doppler puissance et l’écho 3D au sein de l’unité endomètre/myomètre subendométrial. Technique de mesure de l’angiogenèse La technique de mesure par 3D-PDA consiste à mesurer le pourcentage de voxels colorés au sein du volume endométrial. Elle associe donc une échographie 3D de l’utérus au Doppler puissance (figures 4 et 5). L’opération comporte trois étapes : - la première étape est l’acquisition du volume avec le Doppler puissance ; - la seconde est la définition de la géométrie de surface par la rotation d’un plan d’image autour d’un axe fixe ; - la troisième et dernière étape est le calcul automatique de la vascularisation grâce à l’histogramme 3D couleur. Figure 5. Histogramme des voxels avec mesure automatique des index de vascularisations dans lʼenveloppe. Celui-ci permet de comparer le nombre de voxels de couleur au nombre de voxels en échelle de gris du tissu ultrasonore contenu dans le contour de surface. En effet, à condition d’avoir été obtenu concomitamment au Doppler puissance, le volume contient des voxels colorés, représentant les hématies, et des voxels gris représentant les cellules et le stroma. On obtient ainsi une angiographie des petits vaisseaux, dite angiographie 3DPDA (3D Power Doppler Angiography). Un histogramme des voxels est rendu automatiquement avec les résultats de trois paramètres : – un index de vascularisation (VI) : pourcentage de voxels colorés, reflet de la densité de vaisseaux au sein du volume étudié ; – un index de flux (FI) : l’intensité de ces voxels est cotée de 1 à 100, reflet de l’intensité des flux sanguins ; – un index de perfusion (VFI), produit des deux précédents, représentant la perfusion du tissu ou de la tumeur. Il est parfois intéressant d’étudier la vascularisation en périphérie d’un tissu, par exemple l’endomètre, ou d’une tumeur. Dans ces cas, le programme d’imagerie permet de définir une enveloppe virtuelle, dont l’épaisseur peut être réglée. Au sein de cette couche, les paramètres de vascularisation sont analysés séparément. Résultats La néoangiogenèse endométriale est très fluctuante, fortement influencée par les variations hormonales. Le résultat des études récentes, faites par des groupes différents dans des conditions identiques, est en contradiction avec les données admises jusqu’alors. Il s’avère, en effet, qu’après avoir atteint un pic 2 à 3 jours avant l’ovulation (J0), les paramètres de la néoangiogenèse plongent pour atteindre un nadir à J + 2 c’est-à-dire en pleine période d’implantation. Cette forme de courbe en cloche pendant la phase folliculaire semble être une constante dans les cycles spontanés et pourrait être le témoin d’une bonne réceptivité endométriale. Il se pourrait que croissance de l’endomètre et néoangiogenèse soient des processus plus ou moins indépendants car, d’une part, les fluctuations de l’angiogenèse ne coïncident qu’imparfaitement avec les fluctuations hormonales et d’autre part, l’apoptose joue un grand rôle dans la croissance de l’endomètre. Ces résultats sont en accord avec des études plus théoriques. Avec une technique de laser Doppler intra-utérin, Gannon était parvenu aux mêmes conclusions. Il en était de même dans une étude ayant utilisé la clairance du xénon. La mesure de l’accumulation de l’acide hyaluronique, macromolécule qui accompagne la néoangiogenèse a montré une évolution identique. Il semble donc se confirmer que, contrairement à ce que l’on croyait, l’implantation se fait dans un contexte hypoxique. Une certaine hypoxie serait nécessaire à l’implantation en favorisant la sécrétion de facteurs de croissance locaux ainsi que de facteurs protéolytiques nécessaires à l’implantation. De plus, une inflammation minimale localement éviterait les phénomènes de rejet immunitaire. On sait que les molécules d’acide hyaluronique, outre qu’elles permettent le passage des nutriments ou de l’oxygène, masquent les antigènes à la surface des cellules. POINTS FORTS Mesure de l’endomètre : des règles à respecter. Un nouveau marqueur de la réceptivité endométriale : l’angiogenèse. D-PDA : un nouvel outil échographique pour la mesure de l’angiogenèse endométriale. Implantation : nécessité d’un certain degré d’hypoxie. Prévenir les grossesses gémellaires en FIV par une meilleure appréciation de la réceptivité endométriale.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :