Publié le 12 avr 2015Lecture 8 min
Du nouveau dans les traitements médicaux de l’hémorragie du post-partum ?
D. PROVOST, médecin anesthésiste, CHU de Rouen
Cet article précise la place actuelle d’un nouvel utéro-tonique, la carbétocine, ainsi que les nouvelles propositions concernant la transfusion de globules rouges, plasma frais congelé, plaquettes, concentrés de fibrinogène, facteur VII activé et d’acide tranéxamique en prévention ou en cours d’hémorragie du post-partum.
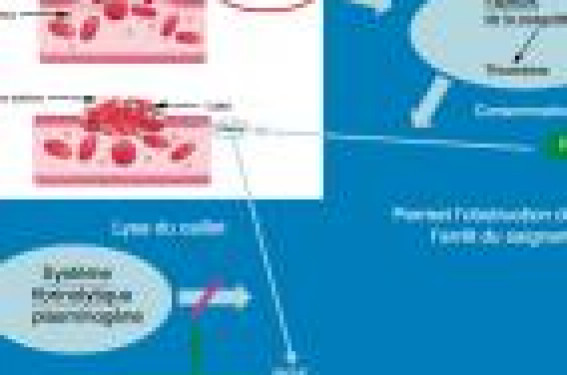
Lors de la délivrance, deux phénomènes physiologiques concourent conjointement à l’arrêt du saignement. La contraction du myomètre qui comprime les artérioles spiralées et l’activation de la coagulation qui permet la formation d’un caillot sur les brèches vasculaires complétant par l’intérieur l’obstruction des plaies. Le traitement de l’hémorragie du post-partum (HPP) agira toujours sur ces deux processus complémentaires. Un nouvel utérotonique : la carbétocine (Pabal®) Analogue synthétique de l’ocytocine d’action prolongée, la carbétocine a l’AMM dans 23 pays pour la prévention de l’atonie utérine après césarienne, mais pas après accouchement par voie basse (AVB) en injection unique. Les données actuelles de la littérature ne permettent pas de dire que la carbétocine soit supérieure à l’ocytocine, qui reste l’utérotonique le plus efficace et le mieux toléré en prévention et à la phase initiale de l’HPP (Cochrane 2014). Ses partisans défendent le fait que l’injection unique limite le risque d’erreurs médicamenteuses et permet un gain de temps, notamment pour la mise en route de la sulprostone si nécessaire. Ses détracteurs sont étonnés de l’absence d’efficacité prouvée après AVB et à la phase initiale de l’HPP d’autant que le coût du traitement par patiente (25 €) est environ 6 fois supérieur à l’équivalent d’ocytocine (25 UI). La dose minimale efficace est probablement plus faible, aux alentours de 20 à 30 µg laissant espérer de moindres effets secondaires, mais cette dose offrirat-elle la même action prolongée ? Carbétocine (Pabal®) – AMM en préventif/césariennes sous ALR – Injection unique 100 µg IVL – 25 € l’ampoule de 100 µg – Non supérieure à l’ocytocine (Syntocinon®) Les médicaments actifs sur la formation et le maintien du caillot Rappel physiologique de l’hémostase d’une brèche vasculaire (figure) Les plaies vasculaires sont responsables d’une activation de la cascade des facteurs de coagulation permettant la formation de fibrine à partir du fibrinogène. La fibrine consolide le caillot formé de globules rouges (GR) et de plaquettes (Pt) permettant ainsi l’obstruction de la plaie et l’arrêt du saignement. Parallèlement à cette activation de la coagulation, le système fibrinolytique est également activé, assurant la lyse du caillot et la perméabilité vasculaire. L’hémostase physiologique résulte d’un équilibre entre coagulation et fibrinolyse. Les facteurs de coagulation et le fibrinogène les plus rapidement consommés sont les facteurs limitants en cas d’hémorragie. Ceux-ci sont augmentés en fin de grossesse en préparation de la délivrance. Figure. Hémostase d’une brèche vasculaire. Équilibre entre coagulation et fibrinolyse. Transfusion de globules rouges, de plasmas frais congelés (PFC) et de plaquettes quoi de neuf ? Classiquement, la transfusion de produits sanguins labiles se basait sur les résultats des examens biologiques d’hémostase. En attendant ces résultats, il était recommandé de traiter l’hypovolémie par perfusion de cristalloïdes ou colloïdes. Tant que l’hémorragie persiste, en plus de la spoliation sanguine, la dilution et la consommation de facteurs de coagulation et de fibrinogène réduisent encore le nombre des éléments indispensables à la formation du caillot en regard de la brèche auto-entretenant l’hémorragie. La meilleure connaissance de ces phénomènes explique les modifications et l’anticipation actuellement proposées. La transfusion de GR Elle a pour but avant tout de maintenir l’oxygénation tissulaire. Les GR sont indispensables à la formation du caillot. Devant la surestimation possible du taux d’hémoglobine en cours d’hémorragie, la difficulté d’évaluer les pertes sanguines souvent sousestimées, du retard fréquent de la transfusion encore observé lors de la dernière enquête de mortalité, la tendance actuelle est de recommander de maintenir le taux d’hémoglobine (Hb) à 10 g/dl tant que l’hémorragie persiste. lLa transfusion de PFC Elle a pour but d’apporter des facteurs de coagulation et du fibrinogène, indispensables à la formation du caillot. Les données actuelles de la littérature sont en faveur de l’administration précoce de PFC avant les résultats des examens biologiques afin de limiter, voire prévenir la coagulopathie de l’HPP massive, espérant ainsi réduire l’importance et la gravité de l’hémorragie. Cependant, la transfusion de PFC a des limites : délai d’obtention long (décongélation et acheminement), apport faible de fibrinogène, risque de complications graves (syndrome de détresse respiratoire aigüe,oedème pulmonairelésionnel lié à la transfusion, syndrome de défaillance multiviscéral), d’où l’intérêt pour de nombreux auteurs du monitorage délocalisé de la coagulation (thromboélastogramme, ROTEM). La transfusion de Pt est classiquement recommandée de façon à maintenir un taux supérieur à 50 000/mm3. Les Pt sont indispensables à la formation du caillot. Pour les mêmes raisons que pour les facteurs de coagulation, l’administration précoce et plus importante de Pt pourrait constituer une bonne stratégie en cas d’HPP. Transfusion précoce en quantité suffisante – CG pour Hb 10 g/dl – Pt et PFC avant les résultats des examens biologiques – PFC environ 200 ml, contient 2 g/l de fibrinogène, 100 € – 7 PFC pour augmenter d’1 g/l fibrinogène = 1 400 ml = 700 € Pourquoi proposer l’apport précoce de concentrés de fibrinogène (Clottafact®) Le fibrinogène est transformé en fibrine indispensable à la stabilisation du caillot par activation de la cascade de coagulation. Le fibrinogène est le facteur le plus augmenté en fin de grossesse (4 à 7 g/l) et le plus consommé au cours des HPP. La concentration de fibrinogène plasmatique à la phase initiale de l’hémorragie est le seul paramètre indépendant qui prédise de la sévérité d’une HPP (Charbit, 2011). Toutes les patientes qui ont un taux de fibrinogène < 2 g/l évolueront vers une forme grave (Cortet, 2012). Les résultats des études, qu’elles soient expérimentales sur modèle porcin, cliniques en chirurgie hémorragique réglée ou à partir d’analyse de cas cliniques en obstétrique, suggèrent tous l’intérêt de la correction précoce de l’hypofibrinogénémie par l’administration de concentrés de fibrinogène. Les résultats de l’étude FIB-PPH trialévaluant l’utilisation de concentrés de fibrinogène à la phase précoce du traitement de l’HPP sont attendus. Le Clottafact®, immédiatement disponible, n’expose pas au risque de surcharge. Clottafact® 1,5 g fibrinogène poudre/flacon dans le réfrigérateur du bloc Administration précoce en attendant PFC, Pt ? 750 € le flacon 2 flacons = 200 ml = 3 g pour augmenter le taux plasmatique (1 g/l) = 1 500 € Place du facteur VII activé recombinant (FVIIa rec) Novoseven® Le FVIIa rec est un puissant activateur de la coagulation. Son efficacité dans l’HPP est reconnue en France depuis 2008, son administration est réglementée par un protocole thérapeutique temporaire (PTT) reconduit en 2012 dans les HPP résistantes à tous les traitements proposés dans les RPC de 2004. Une étude regroupant 272 patientes à partir de 6 séries publiées et 3 registres internationaux, montre qu’une dose moyenne de 80 µg/kg de FVIIa rec permet de réduire, voire d’arrêter le saignement dans plus de 85 % des cas d’HPP, au prix de 2,5 % d’événements thromboemboliques (ETE) (Franchini, 2010). Encore plus récemment, une étude prospective randomisée, non encore publiée, étudiant l’efficacité et la tolérance du FVIIa rec administré précocement quand l’HPP devient résistante à la sulprostone, retrouve une réduction de 40 % de recours aux thérapeutiques invasives (93 %/52,4 % ; n = 84 p < 0,0001) ; 2,4 % d’ETE étaient observés (Aya, 2013). D’autres études sont nécessaires pour préciser tant l’efficacité en termes de réduction du taux d’hystérectomies que le risque thromboembolique réel. En attendant et en pratique • Novoseven® poudre, 1 mg/ml de FVIIa après reconstitution, disponible à la pharmacie. • 60 à 90 µg/kg IVL sur 5 min (4 à 6 mg pour 70 kg). • Après échec de la sulprostone et des thérapeutiques invasives. • APRÈS tentative de correction de l’hémostase, de l’hypothermie et de l’acidose. • Si possible avant l’hystérectomie. • Prévention et surveillance survenue d’ETE en post-partum +++ • 620 € le mg (> 2 500 €/70 kg).
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :